
Основные систематические группы бактерий и актиномицетов
В настоящей книге авторы придерживались в основном системы бактерий и актиномицетов, разработанной крупнейшим советским микробиологом Н. А. Красильниковым в его «Определителе бактерий и актиномицетов» (1949).
Эубактерии и родственные им организмы, по Н. А. Красильникову, подразделяются на 4 класса:
Eubacteriae (истинные бактерии).
Actinomycetes (актиномицеты).
Myxobacteriae (миксобактерии).
Spirochaetae (спирохеты).
В класс Eubacteriae (истинные бактерии) входят организмы с неветвящимися клетками и прочными клеточными стенками, имеющими форму мелких тонких палочек, реже кокков, находятся также нитевидные и спиралевидные формы. Часть эубактерий обладает подвижностью, часть — неподвижные. Движение осуществляется при помощи жгутиков простого строения, состоящих из взаимно перевитых фибрилл.
Часть эубактерий способна формировать эндогенно (внутри клеток) термоустойчивые споры, большинство же представлено неспороносными грамотрицательными формами. Размножаются эубактерии делением, некоторые нитчатые бактерии образуют специальные репродуктивные клетки — гонидии.
Класс Eubacteriae объединяет порядки: Eubacteriales (эубактерии), Chlamydobacteriales (хламидобактерии), Ferribacteriales (железобактерии), Thiobacteriales (серобактерии).
В пределах этого класса могут рассматриваться на уровне порядков почкующиеся бактерии (Hyphomicrobiales), приводящиеся в «Определителе бактерий и актиномицетов» Н. А. Красильникова в группе неклассифицированных организмов, а также многоклеточные бесцветные бактерии, сходные с сине-зелеными водорослями и выделяемые М. А. Пешковым в отдельный порядок Caryophanales.
Таблица. Основные систематические группы
| EUBACTERIALES. Одноклеточные бактерии шаровидной, палочковидной и спиралевидной формы. Грамотрицательные и грамположительные. Раэммножаются поперечным делением клеток. Большинство подвижные. Жгутики расположены полярно на концах клеток или перитрихиально. Некоторые представители способны образовывать эндогенно термоустойчивые споры. Разнообразны по физиологическим свойствам: автотрофы и гетеротрофы. Очень широко распространены в природе. | 1. Грамотрицательные неспоробразующие палочки с одним жгутиком. Типичные представители порядка. Сильно различаются по физиологическим признакам: гетеротрофизм, паразитизм, облигатная галофилия. ) | Pseudomonas, Xanthomonas, Azotomonas, Acetomonas, Aeromonas, Zymomonas, Acetobacter, Bdellovibrio, Halobacterium |
| 2. Неспороносные грамотрицательные палочки с перитрихиальнм жгутикованием. Некоторые представители неподвижны. Гетеротрофы. Есть патогенные формы возбудители тифа, дизентирии, чумы. Представители родов Azotobacter, Bejerinckia могут фиксировать атмосферный азот. Некоторые виды размножаются почкованием (Agrobacterium, Tuberoidobacter). Имеются организмы необычной морфологии: Seliberia, Tuberoidobacter | Bacterium, Serratia, Salmonella, Shigella, Erwinia, Aerobacter, Klebsiella, Proteus, Pasteurella, Chromobacterium, Flavobacterium, Fusobacterium, Achromobacter, Alcaligenes, Beneckea, Agarbacterium, Azotobacter, Bejerinckia, Rhizobium, Agrobacterium, Tuberoidobacter, Seliberia, Haemophilus, Bordetella, Moraxella | |
| 3. Bacillaceae. Грамположительные и грамотрицательные палочковидные бактерии. Способны формировать термоустойчивые эндоспоры. Аэробы (род Bacillus) и анаэробы (роды С1оstridium, Desulfotomaculum). Гетеротрофы | Bacillus, Clostridium, Desulfotomaculum | |
| 4. Spirillaceae. Грамотрицательные бактерии. Клетки имеют вид слабо (вибрионы) или сильно (спириллы) изогнутых палочек с жесткой клеточной стейкой. Аэробы и анаэробы. Гетеротрофы. Есть возбудители болезней (холера) | Vibrio, Cellvibrio, Cellfalcicola, Microcyclus, Spirosoma, Benobacter, Spirillum, Desulfovibrio, Selenomonas | |
| 5. Planococcaceae. Шаровидные Грамположительные подвижные бактерии. Клетки одиночные (род Р1аnococcus) или соединены в группы (род Planosarcina). Гетеротрофы | Planococcus, Planosarcina | |
| FERRIBACTERIALES. Сборная группа одноклеточных бактерий, обладающих способностью откладывать вокруг клеток соединения железа | 1. Ferribacteriaceae. Клетки образуют слизистые стебельки, на которых откладывается гидрат окиси железа. Гетеротрофы | Gallionella, Nevskia, Pasteuria |
| 2. Siderocapsaceae. Клетки образуют слизистую капсулу, иногда капсул нет. Гетеротрофы | Siderocapsa, Sideromonas, Ochrobium, Naumanniella, Siderococcus, Ferrobacillus, Ferribacterium | |
| HYPHOMICROBIALES. Гетеротрофные грамотрицательные неспорообразующие бактерии, клетки которых обладают протоплазматическими выростами - гифами. Размножаются путем образования почек на концах гиф. | Hyphomicrobiaceae. Характеристика та же, что и для порядка | Hyphomicrobium, Pedomicrobium, Ancalomicrobium, Prosthecomicrobium, Blastobacter, Blastocaulis |
| THIOBACTERIALES. Сборная группа одноклеточных бактерий, которые при окислении сероводорода откладывают внутри клеток капельки серы | Achromatiaceae. Типичные представители порядка. Бесцветные одноклеточные бактерии. Аэробы. Гетеротрофы | Achromatium, Thiophysa, Thiosphaerella, Thiovulum |
| CHLAMYDOBACTERIALES. Нитчатые бактерии. Гетеротрофы. Многие способны откладывать в слизистых чехлах (влагалищах) гидраты окиси железа. Растут в виде нитей. Молодые клетки, выходящие из чехла, подвижны, обладают полярным и субтерминальным жгутиками | Chlamydobacteriaceae. Растут в виде нитей, покрытых слизистой капсулой. Гетеротрофы. Аэробы | Sphaerotilus, Leptotrix, Crenotrix, Thiothrix |
| CARYOPHANALES. Многоклеточные нитчатые (трихомные) бактерии. Сходны с синезелеными водорослями (цианобактериями), но бесцветны. Нити подвижные и неподвижные. Некоторые виды образуют эндогенные споры | 1. Oscillospiraceae. Образуют споры. Трихомы различной длины, состоят из дисковидных клеток. Подвижны, жгутпкование перитрихиальное. Анаэробы | Oscillospira |
| 2. Caryophanaceae. Спор не образуют. Трихомы часто подвижны | Caryophanon | |
| 3. Arthromitaceae. Трихомы состоят из цилиндрических клеток. Неподвижны. Споры образуются на дисталъных концах трихомов | Arthromitus, Simonsiella | |
| 4. Pontotricaceae. Трихомы неподвижны, состоят из цилиндрических клеток. Размножаются гормогониями и одноклеточными гонидиями | Pontothrix | |
| ACTINOMYCETALES. Прокариотные микроорганизмы, клетки которых способны к ветвлению и образованию мицелия. Подвижных клеток не образуют. Очень широко распространены в природе | 1. Actinomycetaceae. Типичные представители актиномицетов с хорошо развитым мицелием. Споры формируются путем одновременного расчленения спороносцев на длинные цепочки спор | Actinomyces, Proactinomyces, Chainia, Actmopicnidium |
| 2. Micromonosporaceae. Актиномицеты с хорошо развитым мицелием. Споры формируются путем последовательного отчленения кончика спороносна. Число спор небольшое | Micromonospora, Microbispora, Micropolyspora, Actinobifida, Promicromonospora | |
| 3. Streptosporangiaceae. Актиномицеты с хорошо развитым мицелием. Образуют спорангии, в которых формируются множественные споры | Streptosporangium, Micrcsporangium, Amorphosporangium, Elytrosporangium, Actinosporangium, Intrasporangium | |
| MYCOBACTERIALES. Бактерии, не образующие мицелия. Клетки палочковидные, способны ветвиться. Спор не образуют. Размножаются простым делением или дроблением | Mycobacteriaceae Характеристика та же, что и для порядка | Mycobacterium, Mycococcus, Propionibacterium, Lactobacterium, Pseudobacterium |
| COCCALES. Бактерии с кокковидпыми клетками различных размеров и неправильной конфигурацией. Неподвижные. Спор не образуют. Размножаются делением, перешнуровыванием и почкованием | Соссасеае. Характеристика та же, что и для порядка | Micrococcus, Nitrosococcus, Diplococcus, Neisseria, Streptococcus, Sarcina, Peptostreptococcus, Pediococcus, Leuconostoc, Staphylococcus, Gaffkya, Methanococcus, Peptococcus, Veillonella, Aerococcus |
| ACTINOPLANALES. Прокариотные микроорганизмы, клетки которых способны ветвиться и образовывать мицелий. В процессе развития образуются подвижные клетки - споры или фрагменты нитей мицелия | 1. Actinoplanaceae. Актиномицеты, образующие хорошо оформленные спорангии. Внутри спорангиев формируются подвижные споры | Actinoplanes, Spirillospora, Ampullariella, Pilimelia, Kitasatoa |
| 2. Dermatophilaceae. Актиномицеты, формирующие подвижные споры путем дробления нитей мицелия. Образуемые скопления спор имеют неопределенную форму, без резких очертаний | Dermatophilus, Proactinoplanes | |
| 3. Planosporaceae. Актиномицеты, формирующие подвижные споры на коротких спороносцах воздушного мицелия. Споры покрываются слизистой капсулой, имитирующей оболочку сумки. Однако спорангии, как таковые, отсутствуют | Planospora, Planobispora, Sporichtia, Dactylosporangium | |
| MYXOBACTERIALES. Грамотрицательные бактерии. Клетки гибкие, способны к скользящему движению в слизи. Многие образуют слизистые колонии и плодовые тела | 1. Promyxobaeteriaceae. Не образуют плодовых тел. Образуют либо не образуют микроцист. Активно разлагают клетчатку | Cytopliaga, Sporocytophaga, Flexibacter |
| 2. Archangiaceae. Колонии не имеют правильной формы. Нет оформленных цист | Archangium, Stelangium | |
| 3. Sorangiaceae. Цисты угловатые, собраны в кучу, окруженную общей оболочкой | Sorangium | |
| 4. Polyangiaceae. Оформленные цисты с четкими оболочками. Плодовые тела пигментированы, ветвятся | Polyangium, Synangium, Меlittangium, Podangium, Chondromyces | |
| 5. Myxococcaceae. Палочковидные клетки укорачиваются в цистах, образуют споры | Myxococcus, Chondrococcus, Angiococcus | |
| SPIROCHAETALES. Клетки спирально извиты, змеевидно подвижны, обладают осевой плотной нитью, вокруг которой закручена клетка | Spirochaetaceae. Включает 6 родов, различающихся морфологически, по размерам клетки (мелкиклетки Spirochaeta, гигантские - Cristispiга). Есть паразиты (Borrelia) | Spirochaeta, Saprospira, Cristispira, Borrelia, Treponema, Leptospira |
| MYCOPLASMATALES. Клетки разнородны по форме, размерам, не имеют клеточных стенок. Гетеротрофы. Паразиты и сапрофиты | 1. Mycoplasmataceae. Микоплазмы, не нуждающиеся в стерине | Mycoplasma, Thermomycoplasma |
| 2. Acholeplasmataceae. Стеринзавпсимые микоплазмы | Acholeplasma | |
| Rickettsiales. Мелкие палочковидные и кокковидные грамотрицательные бактерии. Не растут на средах. Облигатные внутриклеточные паразиты, возбудители болезней человека и животных. Аэробы, содержат цитохромы. | 1. Rickettsiaceae. Типичные представители порядка. Паразитируют в клетках тканей животных и растений | Rickettsia, Dermacentroxenus, Coxiella |
| 2. Ehrlichiaceae. Паразитируют в лейкоцитах | Ehrlichia, Cytoecetes | |
| 3. Bartonellaceae. Паразитируют в эритроцитах | Bartouella, Eperythrozoon, Haemobartolpnella, Grahamella | |
| CHLAMYDIALES. Облигатные энергетические паразиты, не способные генерировать АТФ. Анаэробы, не содержат цитохромов. Характеризуются сложным циклом развития | Chlamydiaceae. Характеристика та же, что и для порядка | Chlamydia |
Класс Actinomycetes (актиномицеты) состоит из организмов, обладающих мицелиальными, нитевидными, палочковидными и кокковидны-ми грамположительными клетками. В отличие от бактерий, входящих в другие классы, для типичных представителей актиномицетов (высшие формы) характерно наличие хорошо выраженного ветвящегося септированного или не-септированного мицелия.
Имеются и переходные к типичным актиноми-цетам низшие формы — микобактерии, мико-кокки и микрококки, для которых характерны ветвление на ранних стадиях развития, образование боковых выростов — рудиментов веток.
Класс актиномицетов подразделяется на порядки: Actinomycetales (актиномицеты, не образующие подвижных клеток), Actinoplanales (актиномицеты с подвижными клетками), Мусоbacteriales (микобактерии) и Coccales (кокки).
Класс Myxobacteriae (миксобактерии). Организмы этого класса представлены палочковидными и кокковидными клетками, обладающими, тонкой эластичной (неригидной) клеточной стенкой, благодаря чему они при движении могут изменять свою форму, изгибаться. Жгутиками не обладают. Движение осуществляется по типу скольжения. Миксобактерии способны образовывать микроцисты, а также особые плодовые тела, имеющие самую различную форму.
В класс миксобактерии входит один порядок — Myxobacteriales.
Порядок эубактерии (EUBACTERIALES)
В строгом смысле к истинным бактериям относят одноклеточных бактерий с ригидными клеточными стенками, гетеротрофов, перемещающихся (если обладают подвижностью) с помощью жгутиков. В эту группу входит преобладающее количество прокариотных микроорганизмов.
Клетки эубактерий очень малы и вместе с тем сильно различаются по размерам: от карликовых форм (диаметром около 0,125 мкм) до гигантов, длиной до 10 мкм (Ghromatium okenii). В природных субстратах (илах, почвах) можно встретить стебельковых бактерий, достигающих в длину вместе со стебельком 100 мкм и более. Следовательно, гиганты превышают карликов по размерам в 100 и 1000 раз. Большинство палочковидных бактерий по длине не превышают 5 мкм, по толщине 1 мкм. У многих псевдомонад диаметр клетки равен 0,4—0,7 мкм, у ряда почвенных форм — 0,2—0,3 мкм.
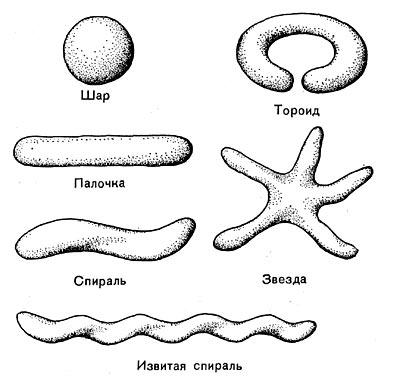
Рис. 14. Основные формы бактериальных клеток. Схема.
Разнообразие форм бактериальных клеток невелико. Основные формы бактерий — это шары (кокки), палочки (прямые, изогнутые или извитые), тороиды и звезды (рис. 14). Клетки многих видов неспорообразующих и спорооб-разующих бактерий выглядят как палочки. Спириллы имеют форму спирали, и ряд близких видов — форму тороида.
Поверхность клеток бактерий имеет часто придаточные структуры. Наиболее распространенными являются жгутики и ворсинки (фимбрии, нитевидные придатки клеток).
Фимбрии (или ворсинки) короче и тоньше жгутиков, имеют вид жестких прямых нитей и, покрывая всю клетку, создают ворсистую поверхность (рис. 15, 16). Длина фимбрий от 0,3—4 мкм, ширина — 0,01 мкм. Иногда они сливаются в комки, придавая неопрятный вид клетке; в других случаях поверхность клеток покрыта войлокообразным чехлом, состоящим из сплетений тонких нитей. Наряду с фимбриями можно видеть капсульный материал, как бы застрявший между нитями фимбрий, выполняющих роль арматуры. Нередко можно встретить лентовидные придатки у клеток. В среде обитания фимбрий выполняют прикрепительные функции, обеспечивая прикрепление клеток к частицам почвы, органических остатков, объединение клеток в группы (рис. 16). Есть сведения о том, что по коротким нитям, соединяющим две клетки и имеющим внутри канал, происходит обмен наследственной информацией. Среди побочных функций фимбрий — защита клетки от нападения паразитов, так как успех атаки паразитов обеспечивается непосредственным контактом с поверхностью клетки хозяина.
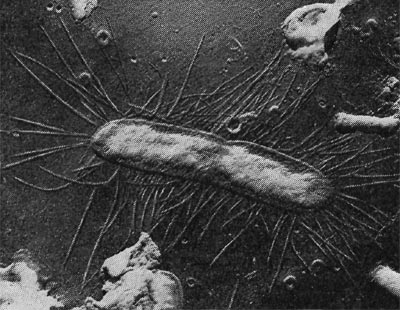
Рис. 15. Палочковидная бактерия с фимбриями. Увел. X 15 000.
Изучение химической природы ворсинок встретилось со значительными трудностями, так как потребовалось их отделить от клетки, «побрить» клетку. К счастью, для исследователей это оказалось возможным проделать в дезинтеграторах — приборах, разрушающих клетки. При этом ворсинки обрываются, после чего их отделяют на центрифугах и накапливают. Как оказалось, они состоят из белка, обладают гидрофобностью (водоотталкивающими свойствами) и локализованы на клеточной стенке, представляя собой как бы «взлохмаченную» стенку клеток.
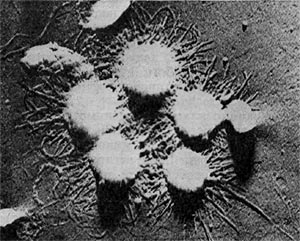
Рис. 16. Кокки с фимбриями. Увел. X 12000.
Другим типом придатков, свойственным многим бактериям, являются жгутики. По структуре они представляют собой гомогенную белковую нить или плотно свернутую косу из 2—3 нитей. Длина жгутиков 3—12 мкм, толщина — 0,02 мкм. Жгутики волнообразно изогнуты и могут быть расположены по всей поверхности клетки (перитрихиально) либо на полюсах (монотрихиально). Они составляют до 2% сухой массы бактерии. Жгутики являются органом движения бактерий, хотя известны случаи существования бездействующих (парализованных) жгутиков. Прикрепление жгутиков к клетке связано с цитоплазматической мембраной (рис. 17, 18). Основание жгутика прикреплено к специальной мембране. При делении у монотрихов дочерняя клетка приобретает полярный жгутик в том месте, где завершилось деление (рис. 19,7). В случае перитри-хиального жгутикования новые и ранее существовавшие жгутики распределяются равномерно (рис. 19,2).
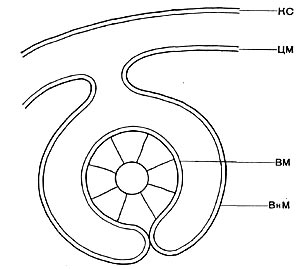
Рис. 17. Схема структуры зоны прикрепления жгутика в клетке бактерии: КС — клеточная стенка; ЦМ — цитоплазматическая мембрана; ВМ — внутренняя мембрана прикрепительного тельца жгутика; ВнМ — внешняя мембрана прикрепительного тельца (по Таушель и др.).
У многих микроорганизмов жесткая клеточная стенка окружена слоями слизистого материала, образующего капсулы разной плотности и толщины (рис. 20). Основными компонентами капсул являются вода и полимеры — полисахариды. Особенно обильное образование слизи наблюдается у многих микроорганизмов в тех случаях, когда среда содержит сахарозу. Молочнокислая бактерия Leuconostoc mesen-teroides за несколько часов превращает раствор в студень — декстран, который используют как заменитель крови, для повышения вязкости водных растворов. Препарат из декстрана — сефадекс — применяется в лабораториях в качестве «молекулярного сита» для разделения веществ с большой молекулярной массой.
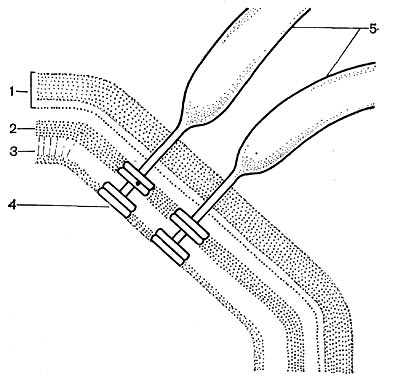
Рис. 18. Схема прикрепления жгутика: 1 — клеточная стенка; 2 — цитоплазматическая мембрана; 3 — мембрана жгутиков; 4 — диски основания жгутиков; 5 — жгутики (по Броку, 1970).
Основным структурным компонентом клетки бактерий является клеточная стенка, которая придает протопласту микроба характерную для него форму. Когда целостность стенки нарушается, образуется сферический протопласт (при участии внутриклеточного осмотического давления, достигающего 20—50 атм и более). Клеточная стенка составляет от 10 до 50% сухой массы бактерии. Количество материала клеточной стенки увеличивается с возрастом.
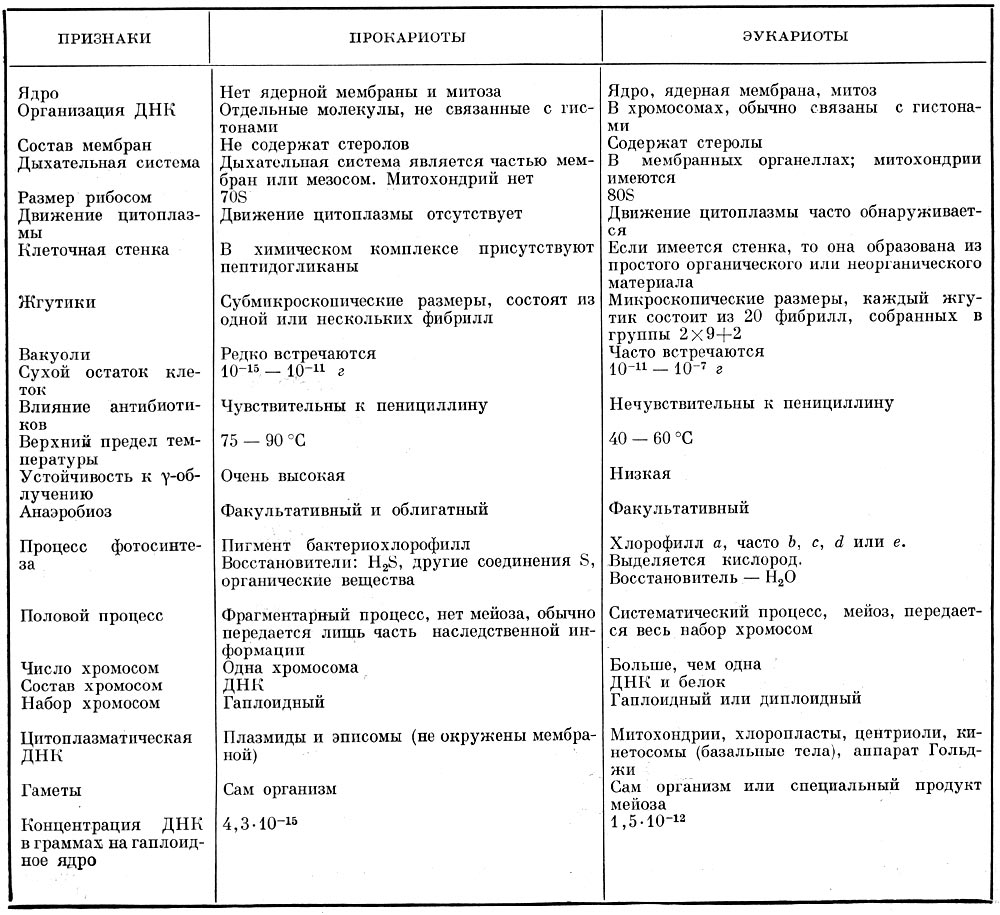
Таблица. Сопоставление признаков прокариотных и эукариотных организмов
Исследования последнего десятилетия по биохимии клеточной стенки бактерий являются крупнейшими достижениями современной микробиологии, позволившими понять молекулярную организацию микробной стенки. Как уже упоминалось ранее, в зависимости от строения клеточной стенки эубактерии разделяются на 2 группы — грамположительные и грамотрицательные. В стенках грамположи-тельных бактерий очень высокое содержание гликопептидов (95% от суммы веществ стенки), однако их строение более простое, чем стенок грамотрицательных бактерий. В стенках грам-отрицательных бактерий лишь 5% гликопептидов. Этот слой покрыт рыхлым слоем белка, который, в свою очередь, прикрыт липополиса-харидным и липопротеидным слоями, пронизанными каналами (рис. 21 и 6).
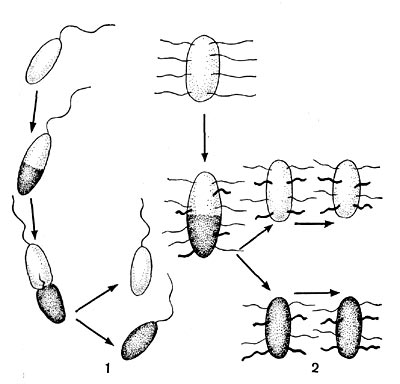
Рис. 19. Распределение и образование жгутиков во время деления клеток: 1 — организм с полярным жгутиком, 2 — перитрих. Схема.
Муреиновый мешок выполняет у бактерий роль опорного каркаса. У грамположительных бактерий он многослоен, у грамотрицательных — однослоен. По существу дела, этот слой представляет собой одну молекулу, покрывающую бактериальную клетку.
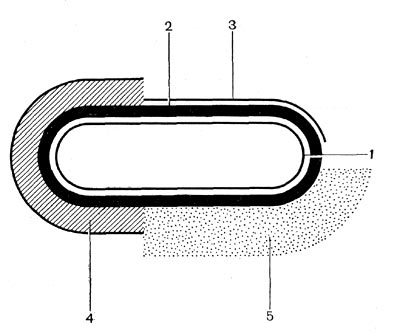
Рис. 20. Схема взаиморасположения внешних слоев клетки бактерий: 1 — цитоплазматическая мембрана, 2 — клеточная стенка, 3 — микрокапсула, 4 — капсула, 5 — слизистый слой.
Все описанные здесь особенности прокари-отных организмов являются исключительно своеобразными, свойственными представителям этого удивительного мира микроскопических существ. Внешний вид и функционально аналогичные органы (жгутики, реснички и др.) оказываются иными у эукариотных клеток.
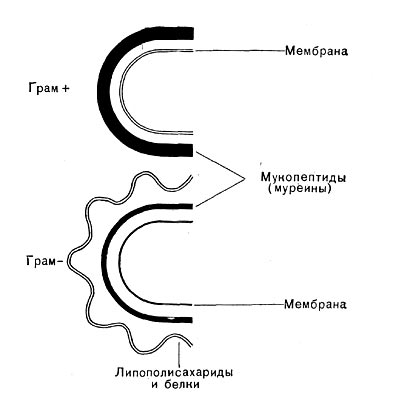
Рис. 21. Схема строения клеточных стенок грамположительных (Грам+) и грамотрицательных (Грам -) — бактерий.
Уникальны также структура и состав клеточных стенок бактерий. Структурные элементы стенок представляют ахиллесову пяту бактерий, так как некоторые лекарственные препараты действуют только на стенки бактерий, не затрагивая эукариотных клеток высших организмов.
Многие победы современной медицины основаны на специфичности клеточных стенок наших друзей и врагов — прокариотов.
Большие различия между эукариотами и прокариотами обнаруживаются и в мембранном аппарате клеток (в химическом составе и структуре). Так, например, у бактерий нет истинных митохондрий, играющих роль энергетических депо клеток. Их функции выполняют простые мембранные структуры (мезосомы). Особенности питания, транспорт веществ через стенку, богатейший спектр веществ, синтезируемых бактериями, особенности дифференцировки клеток, большая скорость размножения и адаптации к среде делают прокариотов истинными хозяевами и вершителями процессов круговорота веществ в биосфере.
Сопоставление некоторых свойств прокариотных и эукариотных организмов приведено в таблице на стр. 208.
Семейство псевдомонады (PSEUDOMONADACEAE)
Типичными представителями эубактерии являются грамотрицательные неспороносные бактерии, объединяемые в семейство Pseudomo-nadaceae. Название семейства происходит от двух греческих корней: «псевдо» — сходный и «монас» — название группы простейших (животных) с полярно расположенными жгутиками. Поэтому к псевдомонадам относят как палочковидные бактерии с полярно расположенным жгутиком, так и слабоизогнутые палочки, физиологически крайне специализированные ав-тотрофные хемосинтезирующие бактерии (Нуdrogenomonas, Nitrosomonas, Thiobacillus) и обычные гетеротрофные бактерии (Pseudomonas), т. е. смешиваются представители питания — автотрофного и гетеротрофного.
Следовательно, в семейство Pseudomonada-сеае входят грамотрицательные палочки, растущие в аэробных условиях или получающие энергию за счет анаэробного дыхания либо за счет связанного кислорода (денитрификация), но не брожения. Псевдомонады используют широкий спектр органических веществ, в том числе циклических соединений (гетероциклических и ароматических). Благодаря «всеядности» псевдомонады распространены повсеместно: в воде, почве, илах, переносятся с током воздуха. Многие из них образуют водорастворимые и флюоресцирующие пигменты.
Патогенность у псевдомонад выражена слабо, но даже такой обычно хорошо знакомый микробиологам сапрофит, как Pseudomonas aerugi-nosa, часто является возбудителем вторичной инфекции долго не заживающих ран и язв у человека и животных. Пигменты, выделяемые этим микробом, придают гною сине-зеленую окраску. Вспышки энтерита у новорожденных вызываются этой бактерией. Она же вызывает заболевания растений (табак и салат) и смертельные заболевания домашней птицы. Представители другого рода (объединяет 65 видов) — Xanthomonas — наносят большой вред сельскому хозяйству, деревообрабатывающей и другим видам промышленности, где используется растительное сырье. Они вырабатывают ферменты, которые разрушают протопектины — вещества, цементирующие клетки растений. Этот процесс приводит к ослизнению растительной массы, а растение — к гибели.
Род псевдомодас (PSEUDOMONAS)
Бактерии этого рода широко используются в хозяйственной практике, а также в качестве моделей для многочисленных теоретических исследований, поэтому мы и остановимся на этих микроорганизмах подробнее.
В 50—60-х годах нашего столетия в мировой и отечественной литературе появилось большое количество научных исследований о бактериях рода Pseudomonas, в частности об их флуоресцирующей группе. Эти исследования касаются вопросов использования флуоресцирующих бактерий для решения ряда практических и теоретических задач. Существует много патентов и научно-исследовательских работ американских, японских и советских авторов, где подробно представлены характеристики продуцентов, состав сред для выращивания бактерий и описаны условия культивирования для получения значительных количеств различных биологически активных соединений.
Так, при использовании в качестве продуцентов некоторых штаммов бактерий Ps. fluorescens осуществляется биосинтез органических кислот: глюконовой, 2-кетоглюконовой, а-кетоглутаровой и пировиноградной. Для получения аминокислот: глутаминовой, l - аспарагиновой, валина и метионина — также используются различные представители бактерий Pseudomonas fluorescens и Ps. aeruginosa.
Из окрашенных веществ, синтезируемых бактериями рода Pseudomonas, были выделены химические вещества, обладающие антибиотическими свойствами, — пиоцианин, хлоро-рафин, оксихлорорафин, феназин-1-карбоновая кислота и эругинозин. Все перечисленные пигменты обладают антибиотической активностью против грамположительных и грамотрицатель-ных бактерий, дрожжей и грибов.
Кроме антибиотиков, в состав окрашенных веществ, синтезируемых псевдомонадами, входят витамины. Советские и зарубежные исследователи еще в 30-х годах нашего столетия отмечали, что в состав желто-зеленого флуоресцирующего пигмента, синтезируемого псевдомонадами, входят рибофлавин, фолиевая кислота, птерин. Использование современных методов исследования позволило выделить в кристаллически чистом виде и определить составные части витаминов птеридинового и каротиноид-ного типов, образуемых псевдомонадами.
В работах советских и зарубежных исследователей последнего десятилетия отмечается, что флуоресцирующие псевдомонады могут быть продуцентами ферментов. Так, советские исследователи изучают процесс синтеза фермента аспарагиназы, используя Ps. fluorescens. Ac-парагиназа обладает канцеростатическими действиями. В ФРГ организовано производство фермента пероксидазы. В качестве продуцента пероксидазы также используют бактерии Ps. fluorescens.
В практике контроля пищевых продуктов флуоресцирующие псевдомонады издавна известны как индикаторы на зараженность.
Интенсивное развитие бактерий на пищевых продуктах сопровождается выделением флуоресцирующего пигмента. Этот признак применяется при отбраковке пищевых продуктов.
Решение ряда теоретических вопросов осуществляется с помощью модельных опытов с бактериями рода Pseudomonas: изучаются некоторые пути углеводного и аминокислотного обмена, отдельные этапы процесса дыхания микроорганизмов.
Японские и американские исследователи использовали псевдомонады для получения кристаллического цитохрома и изучения его аминокислотного состава.
Бактерии рода Pseudomonas широко распространены в природе. Их можно встретить в воздухе, почве, морских и пресных водоемах, сточных водах и иле, нефти и на газовых месторождениях. Псевдомонады были обнаружены на пищевых продуктах, телах животных, растениях, а также в гнойных ранах и экскрементах больных млекопитающих.
Интерес к этой группе бактерий все больше возрастает. Кроме микробиологов, фитопатологов и медицинских бактериологов, псевдомонады привлекают внимание также и ученых других профилей: лимнологов, почвоведов и т. д.
По Красильникову, бактерии рода Pseudomonas монолитны по морфологическим и очень разнообразны по культуральным и физиологическим признакам.
Клетки псевдомонад представляют собой мелкие одиночные грамотрицательные палочки. Спор и выростов не образуют, подвижны, имеют полярно расположенные жгутики. Число жгутиков у разных видов колеблется. Клетки в культурах часто объединяются в небольшие комочки или зерна, окруженные толстой слизистой оболочкой, иногда резко очерченной, — зооглеи.
К настоящему времени накопилось достаточно сведений, чтобы использовать некоторые биохимические признаки для таксономической характеристики рода. Так, например, химический состав клеточной стенки бактерий постоянен и, как правило, не изменяется на различных стадиях развития культуры или при возникновении мутаций. У бактерий рода Pseudomonas процент Г + Ц (гуанин + цитозин) в ДНК колеблется в пределах 58—69%.
Колонии бактерий очень разнообразны: слизистые и пастообразные, выпуклые и плоские, крупные и мелкие. У многих видов отмечается внутренняя структура колоний. Если их рассматривать в микроскопе при малом увеличении, то в одних случаях можно обнаружить мелкозернистую колонию; в других — ячеистую, напоминающую соты; в третьих — колонии в виде мелких комочков или зерен. Большинство видов имеет колонии без внутренней структуры — под микроскопом они выглядят как однородная гомогенная масса. Псевдомонады хорошо растут на обычных питательных средах — сложных органических.
Культуры различаются между собой способностью разлагать белки, использовать углевод, расщеплять крахмал, клетчатку, углеводороды, соединения ароматического ряда и другие сложные по составу вещества.
Большинство бактерий рода Pseudomonas обладает гетеротрофным типом обмена веществ, т. е. для построения тела им требуется готовое органическое вещество. Биосинтетические процессы, при этом осуществляются за счет обмена окислительного типа, где кислород является конечным акцептором электронов, перенос которых связан с системой цитохромов. Некоторые представители этого рода могут существовать за счет анаэробного нитратного дыхания, другие используют энергию окисления водорода. Многие виды псевдомонад образуют пигменты, различные по окраске и химической природе; некоторые синтезируют витамины, антибиотики, токсины.
Среди представителей бактерий рода Pseudomonas есть формы, токсичные для животных организмов (патогенные бактерии). Имеется также немало фитопатогенных видов, поражающих растения.
Характеристика отдельных видов и групп бактерий рода Pseudomonas
В «Определителе бактерий и актиномицетов» (1949) Н. А. Красильникова описано более 200 видов бактерий рода Pseudomonas. Это наиболее полное и пока единственное систематическое описание, где представлены характеристики почти всех известных псевдомонад, которые распределены между собой в зависимости от характера своих признаков.
Для разделения этих бактерий на виды использован легко наблюдаемый признак пигментации, а также морфологические, культу-ральные и некоторые физиологические свойства. Особенно отмечен признак токсичности бактерий по отношению к животным и растительным организмам.
Ps. aeruginosa — классический представитель рода Pseudomonas. Различные штаммы этих бактерий можно обнаружить всюду: в почве, воде, воздухе, гнойных ранах и сточных водах. По сравнению с другими видами псевдомонад эти формы наиболее интенсивно исследуются бактериологами, изучающими патогенную группу, и фитопатологами. Бактерии Ps. aeruginosa обладают особым разнообразием свойств, но в то же время у них отмечаются характерные общевидовые морфологические и физиологические признаки. Клетки бактерий представляют собой мелкие палочки (1,0 — 1,5 х 0,5мкм), одиночные или соединенные в пары; имеют один-два, редко три полярно расположенных жгутика, грамотрицательные. Культуры образуют синий флуоресцирующий пигмент, в состав которого входят пиоцианин. Бактерии желатин разжижают, молоко не свертывают, не пептонизируют, нитраты восстанавливают до нитритов, используют углеводы с образованием кислоты; аэробы. Температурный оптимум развития около 37 °С. Окисляют глюконат, образуя слизь. Являются сильными окислителями углеводов (сахаров, органических кислот, углеводородов). Среди этих бактерий встречаются подвижные и неподвижные формы. Многие культуры синтезируют окрашенные соединения различных типов, хорошо проникающие в субстрат. В состав пигментов входят соединения феназинового и пгеридинового ряда, а также флуоресцирующие сине-зеленые и желто-зеленые вещества.
Качественный состав пигментов и их количественный набор зависят от условий культивирования, немалое значение имеет и экологический фактор.
К этому виду близко примыкают бактерии Ps. schuilkilliensis, которые синтезируют сине-зеленый флуоресцирующий пигмент, диффундирующий в субстрат; температурный оптимум развития около 37 °С. Желатин разжижают медленно.
Культуры Ps. syncyanea образуют сине-зеленый флуоресцирующий пигмент. Желатин не разжижают, нитраты не восстанавливают; аэробы. Температурный оптимум развития около 25 °С.
Ps. scissa. Клетки мелкие (1,0x0,3 мкм), подвижные. Бактерии образуют желто-зеленый флуоресцирующий пигмент. Желатин не разжижают, молоко не изменяют, нитраты восстанавливают до нитритов; аэробы. Оптимум температуры роста около 27 °С. Эти псевдомонады были выделены из воды и почвы. К виду относятся 6 различных штаммов бактерий, обладающих сходными свойствам-и.
Ps. atlantica. Клетки мелкие, подвижные, с полярным жгутиком; колонии гладкие, блестящие. Культура энергично разжижает агар-агар и желатин, молоко пептонизирует, крахмал разлагает, нитраты не восстанавливает. Бактерии относятся к аэробам. Оптимальная температура роста около 25 °С. Эти псевдомонады были выделены из морской воды (Атлантический океан).
Ps. fluorescens. Мелкие палочки (1 —2 X 6 мкм), подвижные, имеют 2—4 полярных жгутика. Бактерии грамотрицательные. Культуры бактерий образуют зеленовато-желтый флуоресцирующий пигмент, который проникает в субстрат. Представители этого вида не синтезируют пиоцианин; хорошо развиваются на органических и синтетических средах. Колонии бесцветные или белые, выпуклые, гладкие, блестящие. Характерной особенностью этого вида является внешняя микроструктура колоний: при малом увеличении микроскопа поверхность колоний имеет характерное сетчатое или ячеистое строение. В бульоне бактерии образуют муть и пленку. Желатин разжижают, молоко не свертывают, нитраты восстанавливают до нитритов, образуют кислоту на глюкозе и сахарозе; аэробы. Оптимальная температура роста около 25 °С. Бактерии часто встречаются в воде, почве, на разных растительных и животных субстратах; не патогенны для животных.
Особое место занимает вид Ps, aurantiaса. Описание морфологических, культураль-ных и некоторых физиологических свойств бактерий этого вида встречается в основном в работах советских исследователей. Клетки бактерий этого вида палочковидные, 2—3 х 0,6 мкм, подвижные, имеют на конце 2—5 жгутиков. Колонии на питательных средах окрашены в оранжевый или красно-желтый цвет, гладкие, блестящие, плоские или выпуклые. Пигмент диффундирует в субстрат. Культуры хорошо растут на обычных питательных средах; желатин разжижают, молоко пептони-зируют. Кислоту образуют при росте на глюкозе, сахарозе, манните, глицерине. Нитраты не восстанавливают, крахмал не разлагают, аэробы. Оптимальная температура роста около 25 °С. В состав оранжевого пигмента входит несколько веществ различной химической природы.
Морфологические, культуральные и физиолого-биохимические признаки псевдомонад
В последнее десятилетие появились фундаментальные исследования, касающиеся таксономической характеристики отдельных групп и видов бактерий рода Pseudomonas. В этих работах подробно описываются различные морфологические, культуральные и физио-лого-биохимические признаки некоторых групп, видов или отдельных представителей бактерий этого рода. Японские исследователи И и ц у -ка и Ком агата (1963) в своей монографии представили таксономическую характеристику 202 штаммов, относящихся к 28 видам псевдомонад. Эти бактерии были разделены на три группы на основании характеристики образуемых ими пигментов.
Флуоресцирующие бактерии.
Эта группа объединяет представителей 12 видев бактерий.Все они синтезируют водорастворимые флуоресцирующие пигменты от желто-зеленого до оранжевого оттенка. Некоторые из них образуют синий пигмент, нерастворимый в воде. Бактерии этой группы активно разлагают углеводы. При росте на средах с гексозами образуют кислоты; на средах с лактозой и крахмалом не развиваются. Потребляют органические кислоты, растут на средах с ароматическими соединениями; аэробы. Восстанавливают нитраты до нитритов. Сероводород и индол не образуют. Распространены в воде, почве, сточных водах.
Ахромогенные бактерии.
В эту группу входят бактерии, которые не синтезируют пигментов. Используют сахара, органические кислоты. Восстанавливают нитраты до нитритов. Сероводород и индол не образуют. Выделены из пищевых продуктов (пива, мяса).
Хромогенные бактерии.
Эта группа объединяет бактерии 6 видов. Фитопатогенных форм среди них нет. Все бактерии образуют желтый пигмент, нерастворимый в воде; аэробы. Восстанавливают и потребляют нитраты. Гидроли-зуют крахмал. Образуют сероводород и индол. Выделены из почвы.
Японские авторы отмечают, что результаты, полученные при сравнении способности использовать различные углеродные соединения, подтверждают правильность разделения бактерий рода Pseudomonas на три группы по признакам пигментации. Все штаммы, отнесенные к флуоресцирующей группе, имеют общие свойства: подкисляют среду при использовании глюкозы, потребляют глюконат, разлагают ароматические соединения, обладают высокой активностью фермента цитохромоксидазы. Всех этих свойств у бактерий, отнесенных к ахро-могенной и хромогенной группам, обнаружено не было. Следовательно, существует явная корреляция между характером углеводного обмена бактерий рода Pseudomonas и их пигментацией.
Американские ученые Станиер с сотрудниками (1966) представили фундаментальное исследование по таксономии бактерий рода Pseudomonas, положив в его основу физиолого-биохимические свойства этих бактерий. Было изучено 267 штаммов, принадлежащих к 10 видам. Значительная часть таксономических данных была получена путем применения метода, предложенного Дюреном де Ионгом (1926), который заключался в детальном изучении пищевых потребностей у большого количества бактерий. У каждого штамма изучали способность использовать в качестве единственного источника углерода и энергии 146 органических соединений. Были изучены углеводы, жирные кислоты, органические кислоты, спирты, ароматические соединения, не содержащие азота в кольце, а также углеводороды.
Кроме того, исследовались: потребность бактерий в источниках азота, ростовых факторах, способность к денрпрификации и другие физио-лого-биохимические признаки.
Цитологические наблюдения включали исследования размера клеток, характера жгути-кования, окраску по Граму, образование включений и т. п.
Полученные данные позволили разделить бактерии рода Pseudomonas на три группы: флуоресцирующую, кислотоиспользующую и щелочеобразующую.
В группу флуоресцирующих бактерий включены бактерии, относящиеся в основном к трем видам (Ps. aeruginosa, Ps. fluorescens, Ps. putida), и несколько представителей других видов. Все они синтезируют водорастворимый желто-зеленый флуоресцирующий пигмент, используют нитраты или соли аммония как источники азота, не образуют поли-в-масляную кислоту в качестве резервного материала в клетках.
Эта группа бактерий делится на семь различных биотипов в зависимости от некоторых специфических признаков: способности синтезировать пигменты феназинового типа, образовывать леван из сахарозы, а также по наличию сильных денитрифицирующих свойств.
Кислотоиспользующие бактерии не синтезируют пигментов; они аэробы, лофотрихи. Все образуют в клетках поли-в-оксимасляную кислоту в качестве резервного материала. Кроме этих признаков, описаны некоторые другие свойства, характерные для определенных штаммов, а не для групп бактерий.
В щелочеобразующую группу входит всего 7 представителей. Все эти бактерии бесцветные, аэробы, с монотрихиальным жгутикованием. Они лучше всего растут при температуре 41 °С. Такие бактерии обладают способностью к дени-трификации.
Бактерии рода Pseudomonas интенсивно изучаются и их характеристика непрерывно обновляется и дополняется.
Обобщая некоторые сведения, накопленные к настоящему времени по таксономической характеристике бактерий рода Pseudomonas, можно отметить, что многие исследователи, пытаясь объединить свои данные по характеристике бактерий и изложить их в определенном таксономическом порядке, не всегда приходят к единому мнению. Это объясняется прежде всего тем, что к настоящему времени накоплено еще мало единых, научно обоснованных данных по оценке тех или иных свойств бактерий рода Pseudomonas.
Пигментация бактерий рода Pseudomonas
Изучение химического состава и природы пигментов, синтезируемых микроорганизмами, получило в настоящее время широкое распространение. Это объясняется тем, что пигменты одновременно могут быть физиологически активными веществами (антибиотиками, ферментами, витаминами, фитонцидами, стимуляторами роста), и также тем, что пигментация микроорганизмов в сочетании с другими физиологическими признаками может быть важным дополнением при систематике микроорганизмов.
Началом биологического подхода к изучению пигментов и некоторых вопросов их образования в клетке можно считать работы советских исследователей школы Н. А. Красильникова. Они установили, что у пигментных форм микроорганизмов существует коррелятивная зависимость между качественным составом пигмента и другими физиологическими признаками. Это касается красно-оранжевой группы актиномицетов, проактиномицетов и микобак-терий, а также зеленых, синих и желтых групп актиномицетов.
Культуры бактерий рода Pseudomonas иногда утрачивают способность синтезировать пигмент. Например, некоторыэ бактерии Ps. aeruginosa могут временно или совсем утратить пигментацию. Известны и беспигментные штаммы этого вида.
Цвет окрашенных соединений, синтезируемых псевдомонадами, различен. Он может быть синим, сине-зеленым, желто-зеленым, желтым, оранжевым, красным, фиолетовым, коричневым и черным. Среди этих соединений есть растворимые и нерастворимые в воде вещества. Их синтез может происходить внеклеточно, а также внутриклеточно с накоплением в клетке и с последующим выходом из нее.
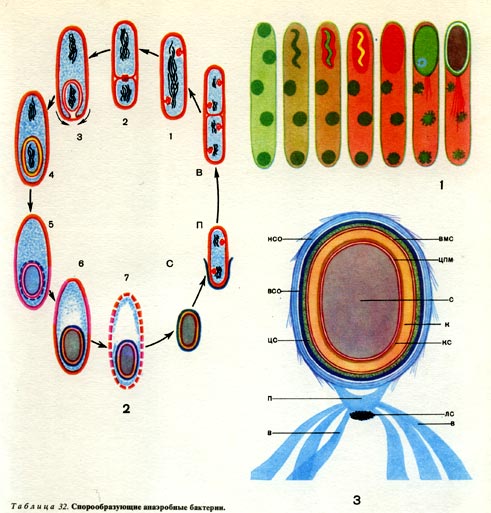
Таблица 32. Спорообразующие анаэробные бактерии.
Как правило, определенные виды псевдомонад одновременно образуют комплекс пигментов различных типов, качественный и количественный состав которых подвержен изменениям и зависит от компонентов среды, условий культивирования (аэрация, освещенность, рН и т. д.), индивидуальных особенностей бактериальных штаммов и источников выделения (экологии бактерий).
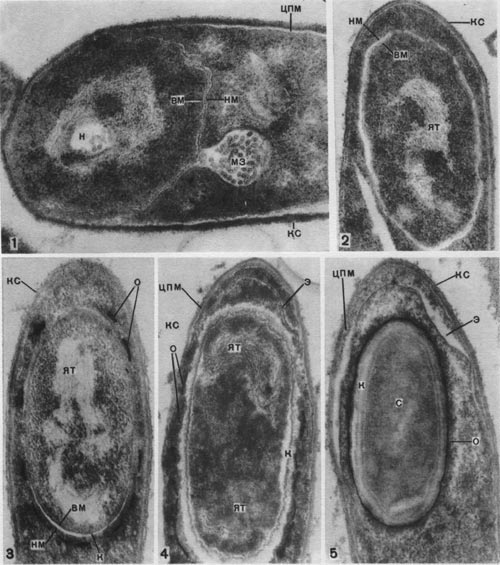
Таблица 33. Спорообразование у анаэробных бактерий: 1 — Clostridium sporotrichum, инвагинация мембраны и образование септы в начале спорообразования: цпм — цитоплазматическая мембрана; вм—внутренняя мембрана проспоры; нм — наружная мембрана проспоры; мз—мезосомы; н — нуклеоид; м — инвагинирующие мембраны; 2 — Cl. sporofasciens, образование проспоры, окруженной двумя мембранами: нм — наружная мембрана проспоры; ем — внутренняя мембрана проспоры; кс — клеточная стенка; ят — ядерный тяж; 3 — Cl. sporotrichum, начало закладки споровой оболочки: о — листки оболочки; нм — наружная мембрана проспоры; ят — ядерный тяж; кс — клеточная стенка; ем — внутренняя мембрана проспоры; к — кортекс; 4 — Cl. penicfflum, нуклеоид в проспоре: о — оболочка проспоры; к — кортекс; э — экзоспориум; цпм — цитоплазматическая мембрана; ят— ядерный тяж; кс — клеточная стенка материнской клетки; 5 — Cl. penicillum, завершение образования споровой оболочки, созревание сердцевины: кс — клеточная стенка материнской клетки; о — оболочка; э — экзоспориум; цпм — цитоплазматическая мембрана; к — кортекс; с — сердцевина споры.
В настоящее время еще нет возможности классифицировать все пигменты, синтезируемые бактериями из рода Pseudomonas, согласно их принадлежности к веществам определенного химического состава.
К настоящему времени известно химическое строение только окрашенных веществ феназинового ряда, некоторых птеридиновых производных, пигментов пиррсльного и каротиноид-ного типов. Эти вещества были выделены в криеталлически чистом виде, а затем было проведено подробное изучение их химических и физических свойств.
Окрашенные соединения феназинового типа
К пигментам — производным феназина — относятся пиоцианин, гемипиоцианин, хлорора-фин, оксихлорорафин, феназин -1-карбоновая кислота, иодинин и эругинозин. Строение этих веществ известно, осуществлен их синтез. Все они являются антибиотиками, обладают активностью против грамположительных и грамот-рицательных бактерий, дрожжей и грибов, а также проявляют фитотоксические свойства.
Пиоцианин и гемипиоцианин — родственные химические соединения, образуемые культурой Ps. aeruginosa. Пиоцианин — синий нефлуоресцирующий пигмент -обычно образуется при культивировании Ps. aeruginosa на естественных и синтетических средах. Начиная с 90-х годов прошлого столетия ученые занимаются подбором сред, обеспечивающих максимальное образование антибиотика пиоцианина. Гемипиоцианин — пигмент желтого цвета.
Хлорорафин и оксихлорорафин — родственные химические соединения. Хророрафин зеленого цвета, оксихлорорафин — желтого. На воздухе хлорорафин быстро окисляется, превращаясь в оксихлорорафин. Эти вещества образуют бактерии Ps. aeruginosa и Ps. chlor or aphis.
Феназин-1-карбоновая кислота — пигмент желтого цвета, образуемый Ps. aeruofaciens. Этот пигмент могут синтезировать некоторые штаммы Ps. aeruginosa и Ps. fluorescens.
Иодинин — пигмент сине - фиолетового цвета с медным блеском — образуется при культивировании Ps. iodinum на синтетических и белковых средах.
Эругинозин — красный пигмент — синтезируется одной из культур Ps. aeruginosa. Этот пигмент состоит из двух веществ, которые были разделены на два пигмента А и В, полученные в кристаллически чистом виде. В 1 л культу-ральной жидкости содержится 12—20 мг пигмента А и 30—40 мг пигмента В. Оба вещества растворимы в воде и нерастворимы в щелочных растворах, на воздухе приобретают желтый цвет. При использовании новейших физико-химических методов анализа (магнитные резонансные спектры) была установлена структурная формула эругинозина В.
Окрашенные соединения феназинового типа могут синтезироваться бактериями рода Pseu-dornoiias в комплексе с другими веществами. Например, один штамм Ps. aeruginosa при определенных условиях может синтезировать одновременно три пигмента.
Окрашенные соединения птеридинового типа
Окрашенные формы псевдомонад синтезируют пигменты, в состав которых входят вещества птеридинового типа. Эти вещества были выделены в кристаллически чистом виде, а использование новейших химических и физических методов анализа позволило изучить их структуру. Птерины входят в состав пигментов и витаминов животной и растительной природы. Впервые они были обнаружены в цветных экстрактах крыльев бабочек и частях тела различных насекомых, в составе пигментов некоторых высших грибов и бактерий.
Среди окрашенных форм рода Pseudomonas часто встречаются виды, синтезирующие яркий желто-зеленый флуоресцирующий пигмент, хорошо диффундирующий в питательную среду. Кроме этих соединений, некоторые виды образуют вещества красного и синего цвета. В комплексе этих окрашенных соединений также обнаружены птерины.
Желто-зеленые флуоресцирующие пигменты. Интенсивность желто - зеленой флуоресцирующей пигментации псевдомонад зависит от условий культивирования, источников выделения и штамма. До настоящего времени точно еще неизвестно, какие органические соединения и сколько их входит в состав флуоресцирующего пигмента.
Начиная с 30-х годов нашего столетия исследователи пытаются установить химическую структуру этих веществ, изучая их в комплексе с другими соединениями, стремясь выделить их в кристаллически чистом виде.
Впервые Эллиот (1958) выделил в кристаллически чистом виде водорастворимый флуоресцирующий пигмент, синтезируемый Ps. fluorescens и Ps. ovalis. Применяя метод электрофореза, он изолировал это вещество и установил его птеридиновую природу. Чаркобарти с сотрудниками (1964), изучая химический состав пигментов, синтезируемых Ps. fluorescens, получил кристаллы светло-коричневого цвета.
Изучение химического состава этого вещества позволило авторам отнести его к птери-диновым производным.
Синие пигменты были обнаружены в клетках Ps. indigofera, которые окрашены в синий цвет. Эти соединения состоят из комплекса веществ различной окраски, где доминирует синяя. Синие пигменты птеридинового типа были получены в кристаллически чистом виде. Изучены их химические и физические свойства, проведен элементарный анализ компонентов и определена структурная формула. К синим пигментам относится индигоидин. Это внеклеточный пигмент фиолетово-синего цвета.
Синий внутриклеточный (нерастворимый) пигмент, также относящийся к птеридиновым производным, накапливается в большом количестве в бактериальных клетках Ps. lemonieri. Этот пигмент в субстрат не диффундирует.
Синий растворимый пигмент обнаружен при культивировании бактерий Ps. nigrifaciens. Коричнево-черные с темными кристаллами на поверхности, колонии этих бактерий содержат окрашенные и неокрашенные клетки, которые располагаются при росте в виде концентрических окружностей. Пигмент был выделен в чистом виде из клеток, затем хроматографи-чески разделен на три фракции: коричневого цвета, синего и флуоресцирующую желтого цвета.
Из очищенной фракции синего цвета были получены кристаллы. Изучены химические и физические свойства, проведен элементарный анализ и определена структурная формула соединения. По своим химическим и физическим свойствам этот пигмент сходен с инди-гоидином и относится к соединениям птериди-нового ряда.
Пигменты красного цвета. В 1937 г. Маршал изолировал из питьевого родника бактерию, синтезирующую смесь флуоресцирующих пигментов, в состав которых входит красный пигмент. Эта бактерия названа Pa. roseus fluorescens. Бактерии, развиваясь на синтетической среде без железа, синтезируют красный и зеленый флуоресцирующие пигменты. Эти соединения были выделены в кристаллически чистом виде и установлена их химическая природа. В состав комплекса этих пигментов входят птерины, рибофлавин и люмо-хром.
Окрашенные соединения типа пиррола.
Кроме птеридиновых пигментов, бактерии рода Pseudomonas синтезируют красные пигменты — антибиотики, принадлежащие к веществам типа пиррола: пиолутеорин, пирролнитрин, изопир-ролнитрин. Эти соединения были выделены из комплекса других окрашенных веществ в кристаллически чистом виде и установлена их химическая формула. Все эти вещества обладают антибиотической активностью против грамполо-жительных и грамотрицательных бактерий, дрожжей и грибов.
Окрашенные соединения каротиноидного типа.
В работах последнего времени описан ряд штаммов бактерий рода Pseudomonas, которые, развиваясь на специфических синтетических средах, синтезируют внутриклеточные нерастворимые в воде пигменты желтого, розового и красно-оранжевого цвета. Использование современных методов исследования (хроматография, электрофорез и т. д.) позволило установить каротиноидную природу этих соединений.
Так, Ps. echinoides и его мутантные формы, а также Ps. methanica при развитии на синтетической среде синтезируют комплекс желто-оранжевых пигментов каротиноидного типа.
Большое количество пигментов, синтезируемых псевдомонадами, обладает фоточувствительностью, флуоресценцией и различной степенью растворимости. Биологическая роль и пути синтеза этой обширной группы соединений почти не изучены. Тщательное исследование пигментов, образуемых псевдомонадами, необходимо не только для уточнения систематики этого рода, но и для изучения физиологии отдельных видов и штаммов псевдомонад.
Род галобактериум (HALOBACTERIUM)
К этому роду относятся облигатные галофи-лы, способные развиваться в питательных растворах, содержащих не менее 12% соли (NaCl). Экстремальные галофилы выделены норвежским ученым X. Ларсеном из насыщенных растворов солей. При понижении концентрации солей в окружающей среде клеточная стенка бактерий разрушается. Палочковидные клетки превращаются в шаровидные сферопласты. При дальнейшем понижении концентрации соли клетки взрываются, так как внутриклеточное осмотическое давление оказывается очень высоким. Как было изучено, энзимы этих экстремальных галофилов активны лишь при высокой концентрации солей К и Na. Такие микроорганизмы, являясь гетеротрофами и используя энергию органических соединений, погибают в присутствии избытка пищи при поступлении воды в среду, понижающей концентрацию солей. Они не могут не быть галофилами. Являясь представителями своеобразной группы «высоленных форм» жизни, эти микробы обречены на существование в условиях соляной рапы. Любопытно отметить, что поиски этих форм были начаты с порчи рыбы и цветения соли в соляных испарительных бассейнах США (цветение соли отражает массовое развитие экстремальных галофильных бактерий, образующих розовый пигмент).
Род бделловибрио (BDELLOVIBRIO)
Исключительный интерес представляют недавно описанные немецким исследователем Г. Штольпом (1963) бактерии, паразитирующие внутри клеток других грамотрицательных бактерий. В пределах рода достоверно описан один вид — Bdellovibrio bacteriovorus. Бактерия представляет собой мелкую грамотрица-тельную, слегка изогнутую палочку. Размеры клетки: длина — 1 мкм, толщина — 0,3 мкм. Клетки снабжены одним полярно расположенным толстым жгутом (толщина 28 нм по сравнению с типичным жгутиком бактерий, толщиной 15—20 нм). Прикрепляясь к клетке-хозяину, паразит проникает внутрь клетки и развивается там. Именно все эти свойства побудили первооткрывателей дать этим бактериям приведенное выше название. Латинское слово «Bdello», означающее «пиявка», в сочетании с «vibrio» (вибрион) составило родовое название. «Vorus» — значит «пожирающий» — в сочетании с «bacterio» составило видовое название. В итоге эти, несомненно, интересные бактерии получили интригующее название «пиявко-вибрион, пожирающий бактерии».
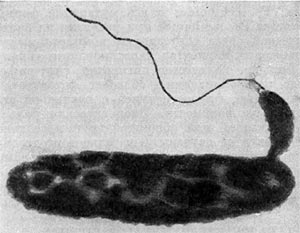
Рис. 22. Прикрепление паразитической бактерии Bdellovibrio к клетке хозяина — Pseudomonas (по Штольлу, 1963).
Немало хлопот доставляет этот организм исследователям ввиду его очень мелких размеров: он проходит через мелкопористые фильтры с диаметром пор, равным 0,45 мкм и даже 0,22 мкм, на которых задерживаются другие бактерии. Bdellovibrio bacteriovorus отличается от подобных ему бактерий прежде всего по тонкому строению жгутика. Он состоит из двух частей — сердцевины (толщина 13 нм) и чехла (7,5 нм), который покрывает жгутик. Чехол является продолжением клеточной стенки на жгутике. На противоположном полюсе клетка-паразит оснащена слизистой маской, лежащей сверху на складках, образованных клеточной стенкой. Этой частью паразит прикрепляется к поверхности клетки-хозяина (рис. 22). Здесь же можно часто видеть очень тонкую (45—55 А) короткую (0,8 мкм) нить, которая, как предполагают, подтягивает клетку-паразита к атакуемой клетке-хозяину. По тонкому строению клетки-паразита неотличимы от обычных грамотрицательных бактерий. Лишь мелкие размеры и способ добывания пищи выделяют их — они проникают внутрь клеток-хозяев и там развиваются (рис. 23 и 24).
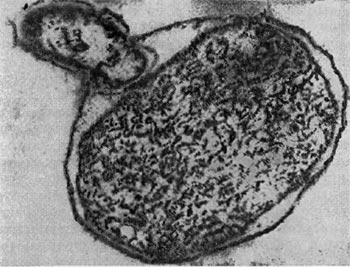
Рис. 23. Прохождение паразита внутрь клетки-хозяина. Ультратонкий срез (по Штольпу, 1963).
Клетки-паразиты не случайно сталкиваются с клетками-хозяевами, а активно ищут их. К слову, следует заметить, что паразиты перемещаются быстрее, чем многие другие клетки бактерий. Если поиск увенчался успехом, то можно под микроскопом увидеть удивительную картину преследования клетки-хозяина (какая - либо грамотрицательная бактерия) двумя-тремя клетками-паразитами. Преследуемая клетка активно сопротивляется, сбрасывая с помощью резких движений прикрепившихся паразитов. Иногда одну клетку-хозяина преследуют несколько клеток - паразитов. Такое разыскивание, преследование и, наконец,внедрение в клетку-хозяина протекает бурно и напоминает атаку (так и называется этот процесс в литературе). Прикрепление паразита начинается с вращательного движения вокруг своей оси, но может быть и шарнирным движением конца клетки-паразита на клеточной стенке хозяина. Скорость вращения достигает 100 об/мин. Прикрепившиеся клетки-паразиты очень прочно связаны с клеткой-хозяином. Их невозможно отделить ни встряхиванием, ни ультразвуком. При длительной обработке они гибнут вместе с хозяином, но не отделяются.
При вращении клетка-паразит пробуравливает клеточную стенку хозяина (см. рис. 23); паразит, проникнув внутрь клетки-хозяина, оттесняет протопласт и располагается между клеточной стенкой и цитоплазматической мембраной, где он многократно размножается. Клетка-хозяин похожа на «мешок», набитый паразитами (20—50 клеток-паразитов в одной клетке-хозяине; рис. 25). Эти интересные наблюдения проведены советскими исследователями Е. Н. Мишустиным и Э. С. Никитиной.
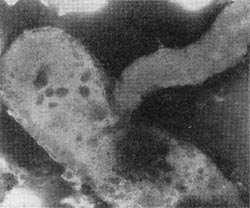
Рис. 24. Атака паразитической бактерией клетки-хозяина. Увел, х 35000.
В настоящее время известно довольно много бактерий, различающихся морфологически, которых относят к роду Bdellovibrio, причем наряду с мелкими вибрионоподобными клетками встречены довольно крупные палочки. Это не должно удивлять, так как в процессе проникновения в клетку через сравнительно маленькое отверстие клетка-паразит сужается и как бы продавливается через отверстие, «просачиваясь» внутрь клетки-хозяина.
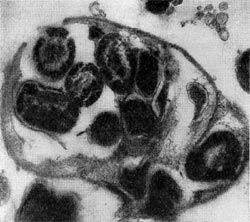
Рис. 25. Клетка бактерии-хозяина (Tuberoidobacter sp.), заполненная размножившимися паразитами. Электронная микрофотография. Увел, х 40000.
Процессы атаки, внедрения паразита внутрь клеток-хозяев протекают очень быстро. Спустя 2—3 мин после атаки клетки-паразиты внедряются в клетки-хозяев. По истечении 10— 60 мин они полностью проникают в хозяев, а через 3—5 ч, завершив разрушение атакованных ими клеток-хозяев, паразиты освобождаются из разрушенных клеток. Инфицированная паразитом клетка уже вскоре после атаки подвергается большим структурным изменениям, что связано в первую очередь с нарушением целостности и прочности клеточной стенки. Изменяются контуры клетки — возникают шаровидные сферопласты. Вслед за стенкой идет разрушение содержимого клеток.
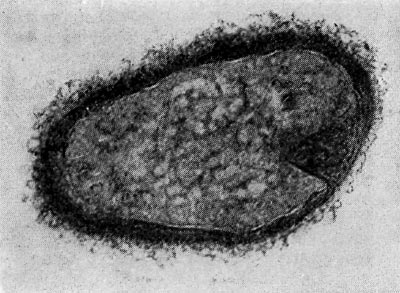
Рис. 26. Цисты (форма покоя) паразитических бактерий Bdellovibrio. Увел. X 50000.
Наряду с паразитическими формами Bdellovibrio возникают сапрофитные, образующие желтый пигмент. Е. Н. Мишустину и Э. С. Никитиной удалось доказать, что часть паразитов, выбравшись из обломков разрушенной ими клетки-хозяина, переходит не к сапрофитному способу питания, а в состояние покоя, образуя цисты. Это овальные, почти круглые клетки с уплотненной ядерной зоной и толстой оболочкой. Размеры их необычайно малы, и они оставались не замеченными многими микробиологами (рис. 26).
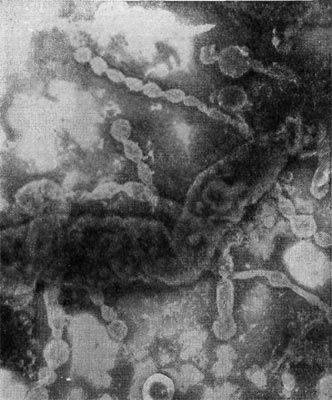
Рис. 27. Разрушенная клетка неспороносной палочки. Видны выброшенные из клетки цепочки внутриклеточных мембран (мезосом). Увел. X 25000.
Особый интерес представляет конечный результат атаки и развития паразитов в клетках других бактерий — их разрушенные (лизиро-ванные) остатки. Такие остатки (детрит) часто обнаруживаются в субстратах, где живут микробы. Они остаются после отмирания стареющих клеток микробных популяций, особей, лизированных фагами, и др. Все указанное относится к эндогенному типу лизиса, когда действующий фактор (в случае отмирания старых клеток сказывается разрушение клетки изнутри ферментами) находится внутри клетки и его действие направлено от центра к поверхности клетки. Bdellovibrio атакует клетку сверху, нарушая целостность клеточной стенки и лишь затем проникая внутрь. Клеточная стенка хозяина разрушается под влиянием ферментов паразита, обнажая ленты мембранных структур (рис. 27). Атакованные паразитами клетки с нарушенной стенкой часто образуют вздутые за счет внутреннего осмотического давления клетки (сферопласты), из которых вышвыриваются наружу цепочки мембран -внутренние структуры (интрацеллюлярные мембраны), на которых ориентированы ферменты, обеспечивающие важнейшие жизненные функции клетки. Эти остатки клеток-хозяев, убитых бактериями-паразитами, еще долгое время остаются в среде, лишь постепенно разрушаясь под влиянием уже других, обычных сапрофитов — «мусорщиков», но все еще остаются на поле битвы следы веществ — индикаторов бурных процессов гибели клеток — составные части клеточных стенок бактерий: мурамовые кислоты, составляющие мешок, покрывающий клетки.
Паразитические бактерии Bdellovibrio широко распространены в природе. Они встречаются в воде рек, озер, морей, в почвах разных географических зон в сравнительно небольших количествах, как бы выжидая момента атаки в случае появления большого количества клеток других бактерий, в первую очередь больных. В этом случае активизируются не только клетки паразита, но и его формы покоя — цисты, которые быстро прорастают. Bdellovibrio выполняют роль волков в микробном сообществе, выедая не всю, а часть популяций клеток (никогда не наблюдалось полного уничтожения хозяев). Объектами атаки (хозяевами) паразитов являются практически все бактерии, но в первую очередь грамотрицатель-ные, в том числе возбудители опасных эпидемических болезней, например холеры. Использование Bdellovibrio (предварительно накопленного в лабораторных условиях) для обеззараживания воды в водоемах уже нашло применение. Характер взаимоотношений Bdellovibrio-пaразита с другими бактериями-хозяевами является ярким примером широко распространенного в живом мире нашей планеты одного из трех способов добывания пищи. Два других — сапрофитный и хищный способ добывания пищи. Тем не менее между этими способами нет больших различий. Сапрофиты питаются мертвыми микроорганизмами, хищники убивают сами или пользуются услугами других «убийц», а паразиты поедают своих хозяев постепенно, совсем не стремясь их убить, по крайней мере немедленно. Таким образом, все живые существа могут быть разделены на «пожираемых» и «пожирающих», и исследование явления паразитизма на любом уровне представляет общебиологический интерес.
Другие псевдомонады
Род ацетомонас (Acetomonas)
К этому роду принадлежат грамотрицательные палочковидные бактерии-монотрихи, способные окислять этанол только до уксусной кислоты. К ним близки представители рода ацетобактер (Асеtobacter) и другие, окисляющие уксусную кислоту до конца.
Род зимомонас (Zymomonas)
Сюда включены палочковидные бактерии с полярным жгутиком, достигающие 2 мкм длины. Сбраживают глюкозу до спирта (около 10%), молочной кислоты и С02. Факультативные анаэробы. Встречаются в бродящих растительных соках.
Семейство бактерии (BACTERIACEAE)
К этому семейству принадлежат грамотрицательные бактерии с перитрихиальным жгути-кованием. Большинство представителей этого семейства — сапрофиты, свободно живущие в воде (пресной и морской), почве, сточных водах, на разлагающихся остатках животных и растений. Сходство между ними очень велико, что часто затрудняет отнесение их к отдельным родам. Часть представителей семейства имеет важное значение для промышленности, сельского хозяйства и медицины. К семейству относится более сотни видов.
Многие виды хорошо сохраняются в воде, почве, сточных водах, молочных продуктах и на растениях. Некоторые патогенны для растений (эрвиниа — Erwinia); другие являются возбудителями тяжелых заболеваний человека: брюшного тифа (сальмонеллы — Salmonella typhi), паратифов, дизентерии (шигеллы — Shigella). Меньшей патогенностью обладают бактерии из рода протеус (Proteus), хотя и они являются возбудителями тяжелых инфекций. Сюда же относится широко распространенная в природе хромобактерия Chromobacterium prodigiosum — палочка чудесной крови, обладающая способностью образовывать кроваво-красный пигмент при развитии на пищевых продуктах. В средние века те люди, у которых хлеб покрывался колониями красного цвета Chromobacterium prodigiosum, подвергались гонениям, вплоть до сожжения на костре в качестве «сообщников дьявола». Так безобидная сапрофитная палочка оказывалась из-за невежества церковников источником страшных бед для многих людей.
В семейство Bacteriaceae входят также представители клубеньковых бактерий (Bacterium radicicola) и рода агробактериум (Agrobacte-rium). Клубеньковые бактерии — Bacterium radicicola, синоним — ризобиум (Rhizobium) будут рассмотрены в разделе, посвященном основной физиологической функции этих бактерий — способности фиксировать атмосферный азот в симбиозе с высшими растениями.
Род бактетриум (BACTERIUM)
Представлен организмами с грамотрицательными мелкими палочковидными клетками с перитрихиальным жгутикованием.
Одной из наиболее изученных бактерий рода Bacterium является кишечная палочка Bacterium coli (в ряде определителей описывается под другим названием — Escherichia coli). Эта палочка всегда содержится в кишечнике людей и животных. Поэтому обнаружение ее в воде и пищевых продуктах свидетельствует об их загрязнении. Некоторые штаммы (разновидности) Bacterium coli вызывают заболевания у людей.
Вряд ли можно назвать другой микроорганизм из огромного мира микробов, который был бы в такой степени изучен и использовался бы в качестве модели для бесчисленного множества исследований энзиматических процессов, закономерностей роста и развития бактерий, тонкого строения клеток, изучения гене тических закономерностей и многого другого, как кишечная палочка. Эта бактерия сыграла в микробиологии, биохимии и генетике такую же роль, как лягушки, кролики и собаки в физиологии и медицине. Именно на Bacterium coli была установлена особенность строения клеточной стенки грамотрицательных бактерий, подтверждена способность неспороносных бактерий выживать длительное время в замороженном состоянии в условиях Антарктиды. Показано, что замораживание при температуре —70 "С и даже при сверхнизкой температуре —195 °С меньше повреждает бактерии, чем замораживание при —20 °С, особенно в случае чередующегося замораживания — оттаивания, что приводит к гибели большинство клеток. В последующем эти сведения были широко использованы в науке и производстве. Исследовалось также отношение бактерий к температуре и установлен порог (45—50 °С), за пределами которого мезофилы (средние по выживаемости при повышенной температуре) не развиваются.
Кишечная палочка оказалась пригодной моделью для выяснения отношения бактерий к засоленности среды. Нижний порог концентрации соли (NaCl) оказался равным 3,5 %.
Исследования, проведенные на кишечной палочке, дали возможность детально изучить биосинтез макромолекул (нуклеиновых кислот, белков) в микробной клетке. Было установлено, что в период активного роста и размножения все процессы биосинтеза макромолекул строго сбалансированы. При влиянии отдельных факторов среды (продуктов обмена веществ, например, аминокислот) действие некоторых ферментов тормозится, что нарушает нормальный метаболизм у микробных клеток. Это приводит к болезни клеток, к возникновению патологически измененных (инволюционных) форм и гибели популяции (сообщества) бактерий.
Прокариотные организмы, типичным представителем которых является Bacterium coli, не обладают истинным ядром, а лишь ядерной зоной, где находятся фибриллы ядерной нуклеиновой кислоты (ДНК) — генетический материал клетки. При быстром лизисе клеток спиральная молекула ДНК выпадает в виде длинной нити, превышающей по длине во много раз клетку бактерий. Например, при длине клетки Bacterium coli 2 мкм длина ДНК — 1100—1400 мкм. Внутри клетки ДНК свернута и не имеет свободных концов, т. е. кольцеобразна. У бактерий имеется одна хромосома, каждый участок которой — ген — ответствен за отдельное наследственно закрепленное свойство бактерий. Для кишечной палочки составлена генетическая карта, на которой указаны места локализации и последовательность генов на кольцевидной хромосоме. Этому предшествовала огромная аналитическая работа, позволившая установить общебиологические закономерности на бактериальном тест -объекте. Для бактерий свойствен половой процесс, сопровождающийся передачей генетического материала при контакте клетки с клеткой — так называемая конъюгация. При этом клетки соединены мостиком, через канал которого генетический материал передается от клетки-донора к клетке-реципиенту. Такая пара клеток объединяется с помощью особых коротких фимбрий, обладающих каналом внутри. По этим каналам передается прежде всего фактор F -- фрагмент ДНК, по величине соответствующий фаговой ДНК, и затем часть хромосомы. Детали механизма передачи хромосом в настоящее время изучаются на Bacterium coli. Трудно переоценить вклад кишечной палочки в современную микробиологию, биохимию и генетику.
Многими исследователями описан ряд видов рода Bacterium, образующих либо не образующих пигменты, широко распространенных в природных средах обитания — в почве, иле, воде. Они играют исключительно важную роль в круговороте веществ в биосфере.
Другие роды семейства
Род хромобактериум (Chromobacterium)
К этому роду принадлежат бактерии, образующие фиолетовый водонерастворимый пигмент — продукт окисления аминокислоты триптофана. Эти бактерии сходны по физиологии с аэробными псевдомонадами.
Род флавобактериум (Flavobacterium)
Представители рода широко распространены в почве и воде, некоторые из них подвижны. Пигмент чаще не образуется. Способны использовать широкий спектр органических веществ. Отдельные виды и штаммы разлагают лигнин (важное вещество природного растительного опада) и некоторые гербициды (вещества, подавляющие развитие растений-сорняков на полях). Сами гербициды и продукты их превращения опасны для человека и животных. К флавобактериям близки бактерии из рода Агарбактериум (Agarbacterium), способные разлагать агар (полисахарид водорослевого происхождения, используемый в лабораторных средах).
Род фузобактериум (Fusobacterium)
В этот род входят облигатно анаэробные грамотрица-тельные палочки, встречающиеся в пищеварительном тракте животных.
Род ахромобактер (Achromobacter)
Представители рода широко распространены в природе, являясь типичными аэробными гетеро-трофами. Хотя они морфологически сходны с бактериями кишечной группы (Bact. coli), серологически между ними родственные связи не проявляются. Многие виды являются обитателями ризосферы (зоны корня) растений. Способны к разложению гербицидов, что характеризует их роль в самоочищении почвы от загрязнения ее неприродными веществами.
Род агробактериум (Agrobacterium)
Типичные представители рода чаще подвижные, аэробные, грамотрицательные палочки. Многие виды патогенны по отношению к растениям. Клетки мелкие (0,2—0,8x1,0—3,0 мкм). Некоторые клетки имеют один жгутик в полярном или латеральном положении; для других характерен пучок или перитрихиальное расположение жгутиков. Количество и локализация жгутиков зависят от питательной среды. Это лишний раз подчеркивает ненадежность характера жгутикования клеток как таксономического признака, и читателю легко оценить несовершенство существующего разделения на отдельные таксономические группы неспорообразую-щих подвижных бактерий по одному из признаков.
Многие виды рода Agrobacterium участвуют в превращении лигнина и гумусовых веществ в почвах. Ряд видов способен, подобно клубеньковым бактериям, жить в тканях растений или в тесной ассоциации с ними.
К этому роду отнесен недавно описанный автором настоящей главы новый почвенный микроорганизм — Agrobacterium polyspheroidum. Клетки этой бактерии представляют собой палочки, вся поверхность которых усеяна сферическими выростами, расположенными по спирали. Размеры клеток средние (0,6—0,8 х l,2—5,1 мкм), но диаметр сферических вздутий очень мал (0,015—0,07 мкм). Поэтому их можно различить только в электронном микроскопе (рис. 28). Молодые шаровидные клетки снабжены одним жгутиком. Размножаются перетяжкой с образованием дочерней подвижной клетки, часто с несколькими жгутиками. Кроме того, клетки нередко образуют почки, длительное время дорастающие до размеров материнской клетки, не отделяясь от нее. По уровню питательных веществ в среде этот организм следует отнести к олиготрофотоле-рантным бактериям, т. е. к бактериям, способным использовать следовые количества источников пищи. Часто встречаются в разных типах почв Европы, Азии и Америки.
Род тубероидобактер (Tuberoidobacter)
В этот род были выделены автором настоящей главы в 1970 г. неизвестные ранее грамотрицатепьные, гетеротрофные, аэробные палочки с бугристыми выростами, чем и определился родовой эпитет (tuberoid — бугорок). Клетки крупные (2—5 х 0,8—0,9 мкм), усеянные бугорчатыми выростами (на ультратонких срезах видно, что выросты сформированы клеточной стенкой и цитоплазматической мембраной, что роднит их с почкующимися и стебельковыми бактериями). Выросты различимы не только в электронном микроскопе, но и в световом (рис. 29). Клетки делятся перетяжкой с образованием меньшей дочерней клетки, снабженной одним или несколькими жгутиками. Бактерии способны также образовывать почки, длительно не отделяющиеся от материнской клетки и достигающие размеров, превышающих материнские. Часто на дочерней клетке, не отделенной от материнской, образуются также почки, в результате чего возникает сложный конгломерат, состоящий из 3—5 и более клеток. Иногда на одной материнской клетке образуется несколько почек. Типовой вид рода — Tuberoidobacter mutans.
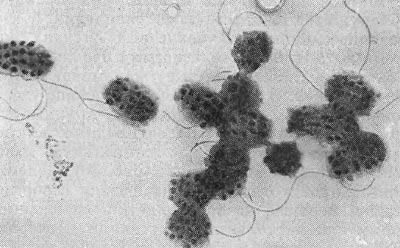
Рис. 28. Почвенная бактерпя со сферическими выступами на поверхности клетки (Agrobacterium polyspheroidum). Увел. X 15000.
По потребностям в источниках энергии эти бактерии относятся к олиготрофам. Повышенные концентрации углеводов тормозят рост, а аминокислоты вызывают заболевания клеток и патологические изменения, завершающиеся гибелью особей. Организмы встречены в почвах с высоким содержанием гумуса и растительного спада. Бактерии из рода Tuberoidobacter обладают признаками, роднящими их как с родом Agrobacterium, так и с почкующимися бактериями.
Род селибериа (Seliberia)
Бактерии, образующие звездообразные скопления, были впервые обнаружены Т. В. Аристовской (1965) - и выделены в самостоятельный род, которому присвоено название Seliberia (по фамилии советского микробиолога Селибе-ра). Эти бактерии очень широко распространены в подзолистых почвах и могут быть выявлены с помощью капиллярного метода Б. В. Перфильева и Д. Р. Габе, в частности, при применении почвенных педоскопов. Педоскопы представляют собой небольшие тонкие пластинки, внутри которых имеются капиллярные каналы. При помещении в толщу почвы в каналах развиваются природные сообщества микроорганизмов, так как каналы педоскопа служат как бы продолжением капиллярных (волосных) ходов самой почвы. За разработку капиллярных методов исследования микрофлоры илов и почв Б. В. Перфильев и Д. Р. Габе удостоены Ленинской премии. Применение капиллярных методов позволило ученым сделать ряд важных открытий. При микроскопировании стенок капилляров педоскопа, пробывшего в подзолистой почве.
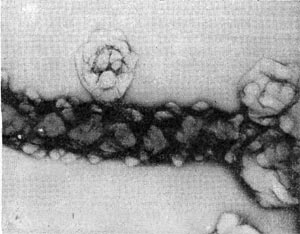
Рис. 29. Клетка бактерии с бугристыми выростами представитель нового рода Tuberoidobacter. Увел. X 30000.
В течение нескольких недель, как правило, обнаруживаются звездчатые скопления бактериальных клеток. В некоторых случаях они покрыты мощными железистыми отложениями. Такие скопления (розетки) напоминают крошечных ежей. В электронном микроскопе удается рассмотреть, что эти довольно крупные (до 10—15 мкм длиной) палочковидные клетки имеют четко выраженную спиральную извитость, напоминающую канат (рис. 30). Деление клеток происходит путем перетяжки с образованием меньшей дочерней клетки, снабженной одним или несколькими жгутиками. Дочерние клетки активно подвижны и слабо извиты. В последующем клетки объединяются в группы, образуя розетки, соединенные слизистой массой, выделяемой одним из полюсов клетки. Встречаются также ветвящиеся клетки.

Рис. 30. Группа клеток Seliberia, образующих звездообразную розетку (по Аристовской 1965). Увел. X 15000.
По физиологическим свойствам бактерии рода Seliberia являются типичными гетеротро-фами и способны развиваться в средах для сапрофитных бактерий, лучше в жидких, чем в плотных средах. Хорошо растут на агаризо-ванной воде и почвенном экстракте. При росте на обычных лабораторных средах морфология клеток значительно изменяется. Иногда клетки сильно вытягиваются и образуют уродливые формы, что свидетельствует о несоответствии обычно принятых сред природным субстратам. Являясь типичными олиготрофами (организмами, растущими на средах с очень низкой концентрацией органических веществ), Seliberia почти не накапливают продуктов обмена в процессе своего развития на органических средах. На средах с углеводами не образуется ни кислоты, ни газа.
В отдельных случаях отмечается очень слабое повышение рН среды. Единственный продукт обмена, который обнаруживается в заметных количествах при выращивании бактерий на гумусовых (гумус — органическое вещество почвы) средах,— гидрат окиси железа. Так как Seliberia не является автотрофом, образование гидроокиси можно объяснить лишь тем, что железо, прочно связанное хелатной (комплексной) связью с гумусом, высвобождается под влиянием бактерий-спутников (они всегда встречаются вместе с Seliberia). Бактерии-спутники активно разлагают гумусовый компонент, а железо в виде гидрата окиси железа оседает на колониях Seliberia со спутниками.
В природе звездообразующие бактерии рода Seliberia встречаются в разных состояниях. Иногда они покрыты отложениями, в других случаях эти отложения отсутствуют. Хотя в биологической аккумуляции железа Seliberia уступает другим видам бактерий, все же их роль в накоплении железа в почве значительна. Можно видеть в толще почвы зоны (пласты) оруднения (металлические слои), которые легко извлечь в виде небольших пластин. В этих процессах роль Seliberia несомненна.
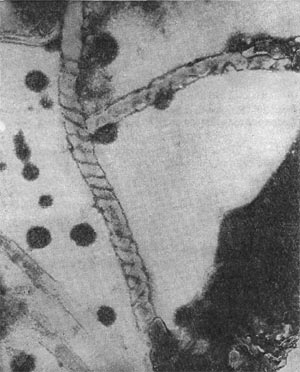
Рис. 31. Извитые клетки неизвестной бактерии. Увел.Х 20000.
Наряду с изученным Т. В. Аристовской типовым видом Seliberia stellata в некоторых южных почвах встречаются подобные организмы, представляющие собой очень длинные клетки, мелко извитые (рис. 31).
На примере изложенного материала читатель легко может заключить, что проблемы систематики бактерий являются одними из наиболее сложных. Так, например, представители рода Seliberia морфологически подобны как типичным неспорообразующим перитри-хам, так и проактиномицетам (ветвление). Являясь гетеротрофами, они обладают уникальными особенностями физиологии (экономный обмен веществ). Несомненно, они занимают особое положение среди неспорообразующих бактерий.
Семейство спириллы (SPIRILLАСЕАЕ)
Представители семейства Spirillaceae имеют форму изогнутых или спиральных клеток, характеризующихся жесткой несгибаемой структурой. Почти все представители семейства близки по многим свойствам к псевдомонадам. Виды этого семейства весьма многочисленны. Среди родов, принадлежащих к этому семейству, наибольшую роль в природе и производстве имеют Vibrio, Cellvibrio, Selenomonas, Microcyclus и др.
Род вибрио (Vibrio)
Свое название эти микробы получили за их способность к быстрым колебательным движениям (от лат. «vibrare» — колебаться). Вибрионы имеют форму коротких, изогнутых в виде запятой палочек. После деления они часто остаются сцепленными концами, образуя спирали. Это — неспорообразующие грамотрицательные бактерии с полярно расположенным жгутиком, типичные гетеротрофы. Они не способны расщеплять клетчатку. Многие используют фенолы и другие циклические соединения. Длина отдельных вибрионов редко превышает 10 мкм, а их диаметр от 1 до 1,5 мкм. Некоторые из них — строгие анаэробы, другие — облигатные аэробы или факультативные анаэробы (растущие в присутствии кислорода и при пониженной концентрации его). В основном это сапрофиты, широко распространенные в загрязненных реках и озерах нашей планеты.
Все же среди представителей этого рода существует несколько видов, патогенных для человека и животных. Сюда относится прежде всего возбудитель холеры (Vibrio comma), выделенный в 1886 г. Р. Кохом из испражнений больных животных. Он может долгое время сохраняться в воде загрязненных рек и озер. Другие виды, вызывающие заболевания людей, — Vibrio proteus и Vibrio El Tor — также опасны. Дорогой ценой оплатило человечество за коварный характер этих вибрионов. Во многих странах Европы можно увидеть много обелисков, посвященных избавлению от холерных эпидемий — естественному затуханию эпидемий, свирепствовавших в течение нескольких лет подряд. Миллионы человеческих жизней были унесены этой мелкой неспорообразующей бактерией. Неописуем ужас людей средневековья перед надвигавшейся на них неизбежной смертью. В настоящее время холера практически побеждена, а в случае заболеваний успешно лечится, в чем большую роль играют антибиотики.
Род селеномонас (Selenomonas)
Представители этого рода являются очень строгими анаэробами. Они обитают в рубце (отделе желудка) жвачных животных (коров, оленей и др.). Морфологически селеномонады представляют собой мелкие вибрионы (длина клетки 2 мкм), снабженные пучком жгутиков, расположенных латерально на вогнутой части клетки. Это типичные неспорообразующие грамотрицательные гетеротрофные бактерии, участвующие в переработке пищи в желудке животного. Их выделение в чистую культуру связано с большими трудностями, так как селеномонады погибают на воздухе в течение нескольких секунд. Культивирование селеномо-над проводится в атмосфере углекислоты, очищенной от следов кислорода.
Род целлвибрио (Cellvibrio)
Бактерии, принадлежащие к этому и другим близким родам, чрезвычайно широко распространены в природе. Это грамотрицательные неспорообразующие вибрионы с длиной клетки до 2 мкм. Типичные гетеротрофы, расщепляющие целлюлозу в растительных остатках, систематически поступающую в почву с растительным спадом. Многие из них способны разлагать парафин и циклические соединения. В лабораторных условиях успешно культивируются на фильтровальной бумаге, наложенной на питательную среду в аэробных условиях. Роль этой группы микроорганизмов исключительно велика, так как они обеспечивают распад важнейшего природного вещества — целлюлозы — и перевод его в соединения, доступные для других организмов, не обладающих ферментным аппаратом, позволяющим расцеплять целлюлозу. Более того, целлюлоза является главным энергетическим материалом, поступающим в природные субстраты за счет основного процесса на нашей планете — фотосинтеза. Затем следует цепочка превращений органических веществ, заканчивающаяся их полной минерализацией. Это обеспечивает нормальный круговорот веществ в природе.
Род микроциклюс (Microcyclus)
К этому роду принадлежат грамотрицательные неспорообразующие бактерии, форма клеток которых напоминает кольца (рис. 32). Обычно размеры клеток невелики (1 мкм), но во время роста клетки образуют замкнутые кольца, диаметр которых 2—3 мкм. Один из недавно описанных представителей этого рода — Microcyclus major (Б. В. Громов, 1963) — характеризуется более толстыми клетками (1—2 мкм) и большим диаметром колец (5 —10 мкм). Организмы из рода Microcyclus и родственного рода Spirosoma неподвижны, жгутики отсутствуют, но у Microcyclus major при развитии на почвенных средах (агаризованная почва) образуется пучок фим-брий (см. выше), с помощью которых клетки объединяются в звездообразные скопления (розетки), подобно бактериям из рода Seliberia.
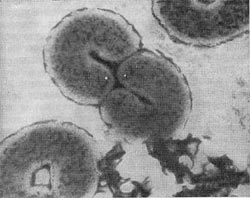
Рис. 32. Тороидальные клетки Microcyclus flavus. Электронная микрофотография. Увел. X 25000.
Являясь гетеротрофами, бактерии из рода Microcyclus и в первую очередь Microcyclus major сильно меняют морфологию своих клеток на богатых средах, где главным действующим фактором являются многие аминокислоты в низкой концентрации (0,02% и меньше). При этом возникают патологические формы клеток: гигантские нити, многократно ветвящиеся клетки, большие шары (сферопласты и протопласты, лишенные клеточной стенки), нитевидные фрагменты со вздутиями, неотличимые от микоплазм (см. стр. 321). По истечении небольшого времени инволюционные формы отмирают. Это значит, что бактерии из рода Microcyclus лвляются довольно типичными олиготрофами, страдающими от избытка пищи. В основе влияния аминокислот на микробы лежит нарушение синтеза клеточной стенки, что ведет к возникновению такого обилия уродливых форм и последующей гибели клеток.
Род спиросома (Spirosoma)
Впервые этот род был описан еще в 1894 г., где были объединены описанные ранее (1875 и 1887 гг.) вибрио-подобные организмы. В дальнейшем культуры были потеряны, а род практически забыт, но в 1968 г. вновь обнаружены формы бактерий, напоминающие спиросомы.
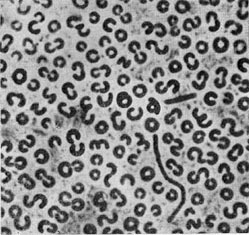
Рис. 33. Тороидальные клетки Spirosoma sp. Фазовоконтрастный микроскоп. Увел. XI600.
Бактерии, относящиеся к этому роду, близки по морфологии к представителям рода Microcyclus. Клетки этих бактерий образуют замкнутые кольца (рис. 33). Разделившиеся клетки, оставаясь вместе, накладываются друг на друга и формируют длинные спирали, число витков в которых от 20—30 до 100. Отдельные клетки невелики (толщина — 0,6—1 мкм, длина — 3,5 мкм), но длина спирали достигает 40— 50 мкм. Этот организм также характеризуется полиморфизмом.
Наряду с нормальными клетками на богатых средах встречаются очень длинные нити (более 50 мкм), сферопласты (клетки, частично потерявшие клеточную стенку).
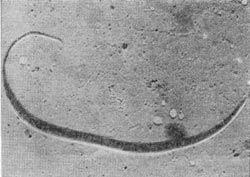
Рис. 34. Червеобразная клетка со сверхтонкими концами неизвестной неспороносной бактерии, обитающей в иле пресного озера в Подмосковье. Увел, х25000.
Все представители рода Spirosoma являются типичными сапрофитами, обитателями воды и ила пресных водоемов, реже встречаются в почвах.
Род ренобактер (Renobacter)
Этот род был введен недавно (Д. И. Никитин, 1970). Описан типовой вид Renobacter vacuolatum (от лат. «ген» — почка). Бобовидная клетка этой бактерии напоминает человеческую почку (табл. 31). Размеры клеток невелики (длина — 1,6 — 1,8 мкм, диаметр — 0,7 —1,0 мкм). Организмы не имеют жгутиков, капсул и спор и являются типичными грамотрицательными бактериями. Характерная особенность этой бактерии — наличие внутри клетки 40—60 газовых вакуолей цилиндрической формы. Отдельные газовые вакуоли окружены тонкими однослойными мембранами и могут заполняться газом (по-видимому, азотом) либо смыкаться. В зависимости от числа раскрытых вакуолей клетки в водной суспензии могут оседать на дно сосуда либо находиться стабильно во взвешенном состоянии и даже плавать в виде пленки на поверхности жидкости. Это дает основание предположить, что у бактерий, лишенных способности к активному движению, выработался принципиально иной механизм перемещения в жидких средах (в том числе в капиллярах, заполненных почвенным раствором). Регулируя число заполненных газом вакуолей, эти организмы при небольших затратах энергии могут перемещаться в зону оптимальных концентраций питательных веществ или уходить от неблагоприятных воздействий среды. Поэтому вполне естественным оказывается распространение Renobacter в почвах с сильным увлажнением, в поймах рек, иле и воде пресных водоемов.
Являясь гетеротрофом, Renobacter vacuolatum на богатых лабораторных средах при избытке белков и аминокислот образует патологически измененные (больные) клетки. Это свидетельствует о том, что Renobacter относится к экологической группе олиготрофов, т. е. организмов, способных развиваться при низких концентрациях пищи. Ее избыток ведет к патологии и гибели клеток.
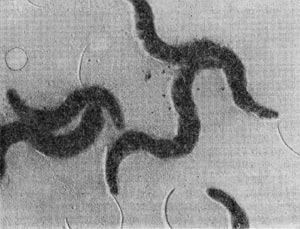
Рис. 35. Клетки крупных спирилл — обитателей пресных водоемов. Увел. X 20000.
Помимо организмов, которых можно более или менее четко отнести к какой-либо таксономической группе, в природных субстратах встречаются новые, неизвестные еще организмы. Такими являются тонкие червеобразные клетки с загнутыми, как правило, очень тонкими концами (рис. 34). Если диаметр клетки этой бактерии равен 0,3—0,5 мкм, то толщина ее концов не превышает 0,07 мкм, и они не могут быть рассмотрены в световом микроскопе. Мир микробов нашей планеты продолжает удивлять и озадачивать нас.
Род спириллум (Spirillum)
Если не считать одной самой мелкой спириллы, то к этому роду относятся лишь безвредные для человека сапрофиты — «мусорщики», соседствующие вместе с вибрионами в тихой заводи стоячих и загрязненных вод (рис. 35) и в гниющих остатках растительного и животного происхождения.
Большинство спирилл относительно крупные (5—40 мкм в длину и 0,5—3,0 мкм в диаметре). Они изогнуты и образуют спираль из нескольких оборотов. Подвижность спирилл обеспечивается одним или пучком жгутиков, прикрепленных к одному или к обоим полюсам клетки. Наиболее мелкий представитель рода — Spirillum minus — патогенен, наиболее крупный — Spirillum volutans — типичный сапрофит.
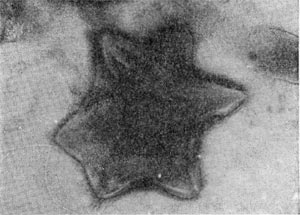
Рис. 36. Шестиугольная клетка новой грамотрицательной бактерии, встречающейся в ипах и торфах. Увел.х 30000.
Новые организмы
Как неоднократно отмечалось, состязание систематики микроорганизмов со все новыми загадками природы продолжается непрерывно. Предъявленный недавно для опознания объект — грамотрицательная не-спорообразующая бактерия с клеткой шестиугольной формы (рис. 36) — не может быть отнесен ни к одному из существующих таксонов (группы классификации) и отнесен сам к себе, оставаясь единственным представителем данной группы. Эта группа получила случайное название — Stella (звезда).
Семейство бациллы (BACILLACEAE)
Палочковидные анаэробные и аэробные бактерии, способные образовывать термоустойчивые споры эндогенным путем (внутриклеточно), относятся к семейству Bacillaceae. Спорообрана 3 рода: клостридиум (Clostricdium), десульфотомакулум (Desulfotomaculum) и бациллюс (Bacillus).
Анаэробные спорообразующие бактерии. Роды клостридиум (CLOSTRIDIUM) и десульфотомакулум (DESULFOTOMACULUM)
Анаэробные микроорганизмы были открыты великим французским ученым Луи Пастером в 1861 году. В то время открытие анаэробов было ошеломляющим для ученых-биологов, полагавших, что жизнь невозможна без дыхания и использования кислорода. Утверждение о существовании анаэробных организмов показалось настолько фантастичным современникам Пастера, что они выступили против него с резкими возражениями. Это свидетельствует о том, насколько смелой, новой была для биологов XIX в. идея о существовании организмов, не нуждающихся для развития в молекулярном кислороде.
После этого события коренным образом изменились представления о разнообразии организации живых существ и энергетических основах жизни. Последующие исследования многих микробиологов показали, что самые различные природные среды, в том числе полностью лишенные молекулярного кислорода, населены множеством микроскопических организмов, принимающих самое активное участие в круговороте веществ на Земле. Кроме того, было обнаружено, что анаэробы могут быть возбудителями ряда опасных инфекционных заболеваний человека и животных. Глубокое изучение обмена веществ анаэробов позволило использовать их в промышленности как продуцентов ряда ценных для народного хозяйства соединений.
Первой анаэробной бактерией, открытой Луи Пастером, была клостридиум бутирикум (С1оstridium butyricum) — спороносная палочка, вызывающая маслянокислое брожение углеводов. В дальнейшем оказалось, что спорообра-зующие анаэробы — не какие-нибудь редко встречающиеся диковинки, а очень широко распространенные по всей поверхности Земли организмы. Вместе с неспороносными формами они составляют большой и удивительно интересный мир анаэробных микроорганизмов, обнимающий почти всю область микробиологии с ее биохимическим и морфологическим разнообразием бактерий. Действительно, анаэробы встречаются почти среди всех известных крупных систематических групп спорообразующих и неспорообразующих форм эубактерий, кокков, хламидобактерий, микобактерий и актиномице-тов, вибрионов, спирилл и спирохет. В последнем определителе (1967) французского ученого , порядки и классы бактерий и актиномицетов.
В данной главе рассказано о спорообразующих анаэробных бактериях, и только об облигатных, т. е. таких организмах, которые не способны развиваться в аэробных условиях, в отличие от факультативных, способных жить как за счет дыхания, используя молекулярный кислород, так и за счет «нитратного дыхания» либо брожения различных органических веществ в -анаэробных условиях. Необходимо отметить, что анаэробные спороносные бактерии хуже" изучены, чем аэробные, из-за значительных трудностей, с которыми встречаются исследователи при выделении и культивировании анаэробов.
Главным условием для проведения точных экспериментов по физиологии, биохимии, цитологии и генетике микроорганизмов является выделение чистых культур. Получить чистую культуру анаэробов очень сложно. В последнее время были созданы специальные приборы — анаэростаты, в которых микроорганизмы можно культивировать на плотных питательных средах в атмосфере, почти полностью лишенной кислорода. Но и при использовании современных приборов и средств выделение и инкубирование чистых культур с высокой степенью анаэробности является крайне трудным делом. Поэтому, вероятно, подавляющее большинство, например, сульфатредуцирующих, цел-люлозолитических и других спороносных анаэробов остаются до сих пор неизвестными. По существу, из этих физиологических групп, широко распространенных в природе, в лабораториях получены лишь единичные культуры.
Колонии анаэробов на агаризованных средах могут иметь самую различную форму, величину и окраску. На рисунке 37 показаны колонии одной из культур анаэробных бактерий -Clostridium sporopenitum. Так выглядят колонии под лупой. А в микроскопе при большом увеличении видно, что колонии состоят из скоплений громадного количества палочковидных клеток бактерий (рис. 38). Вся колония не поместилась в поле зрения, и виден только ее волнистый край. «Штабеля» клеток как бы текут, расползаясь по поверхности питательной среды.
Строение клеток спорообразующих анаэробных бактерий
Все анаэробы, образующие споры, имеют довольно крупные палочковидные клетки с закругленными, заостренными, а иногда как бы обрубленными концами. Величина их варьирует в среднем от 2 — 3 до 7—8 мкм в длину и 0,4—1 мкм в толщину. Среди спорообразую-щих анаэробов встречаются и гиганты (рис. 39, 40), вегетативные клетки которых достигают 15—30 мкм в длину и 1,5—2,5 мкм в толщину. Такие крупные анаэробы часто встречаются в различных природных субстратах, но выделить и вырастить их в лаборатории чрезвычайно трудно. Одну из таких бактерий удалось получить в чистой культуре сотрудникам кафедры биологии почв Московского университета. Эта культура явилась превосходным объектом для цитологических наблюдений, т. е. изучения тонкого строения клеток в процессе их роста, деления и спорообразования.
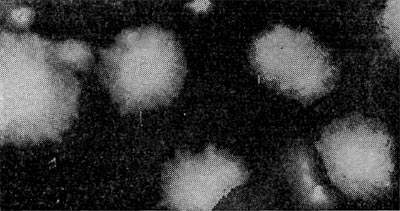
Рис. 37. Колонии Cl. sporopenitum. На темном фоне среды они имеют вид белых платочков с изрезанными краями и муаровой поверхностью. Увел. X 4.
Другие, еще более крупные двуспоровые анаэробы, обитающие в кишечнике головастиков, до сих пор не удалось получить в лабораторных условиях ни в виде чистых, ни в накопительных культурах.
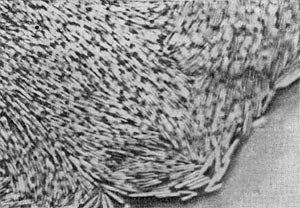
Рис. 38. Край колонии Cl. sporopenitum под микроскопом. Видны скопления клеток в виде «штабелей». Палочковидные клетки расположены радиально: длинной осью они направлены к центру колонии. Увел. X 300.
Вегетативные клетки у большинства видов анаэробов прямые, у меньшей части изогнутые в виде запятой или даже свернутые в калачики — тороиды (рис. 41). У одних видов клетки располагаются поодиночно, у других соединены в цепочки. Подвижные спорообразующие анаэробы обладают многочисленными перитрихиально (по всей клетке) расположенными жгутиками. Но имеются и неподвижные виды, лишенные жгутиков.
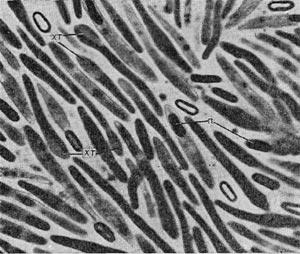
Рис. 39. Живые клетки Cl. sporopeuitum. Видно образование хроматгшовых тяжей и проспор. XT хроматиновые тяжи, П — проспоры. Увел. X 2000.
Капсулы вокруг клеток (рис. 42) имеются у некоторых патогенных (болезнетворных) и сапрофитных анаэробов. Вещество капсул состоит из выделяемых клетками специфических полисахаридов. Размер капсул часто в 2—3 раза превышает диаметр вегетативных клеток.
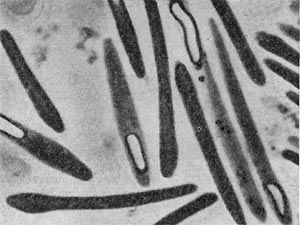
Рис. 40. Созревание спор у Cl. sporopenitum. Форма спор цилиндрическая. Увел. X 3200.
Клеточные стенки.
У анаэробных спороносных бактерий состав и строение клеточной стенки в основном такие же, как и у других грамположительных бактерий. При изучении под электронным микроскопом сверхтонких срезов клеток видно, что клеточные стенки представляют собой самый внешний слой клетки, состоящий из гранулярного и фибриллярного материала (рис. 43).
По толщине клеточные стенки варьируют у разных видов от 200—300 А до 300—400 А. Чаще всего у спорообразующих анаэробов они однослойные, но встречаются виды, у которых стенки разделены на несколько чередующихся светлых (прозрачных) и темных (электронно-плотных) слоев. Самый верхний слой стенки у некоторых плектридиальных форм имеет упорядоченную кристаллоподобную структуру и состоит из очень мелких субъединиц, расположенных в «шахматном порядке» (рис. 44).
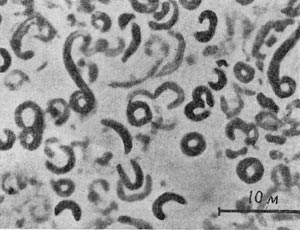
Рис. 41. Вегетативные клеткп в виде вибрионов, торондов и спирилл у Desulfotomaculum sp. (сульфатредуцпрующая бактерия). Увел. X 2100.
Мембранные системы клеток анаэробов имеют строение, аналогичное описанному в главе «Строение и химический состав бактериальной клетки». У анаэробов, как и у аэробов, мезосомы (разрастания мембраны внутрь клетки) связаны с ДНК, участвуя, очевидно, в делении нуклеоида (аналога ядра). При спорообразовании мезосомы участвуют в образовании септы (поперечная перегородка) (табл. 32 и 33).
Ядро.
Анаэробы, как и другие бактерии, лишены настоящего ядра, окруженного мембраной и обладающего набором хромосом, ядрышком и ядерным соком. Вместо этого имеется аналог ядра — нуклеоид. Часто нуклеоид называют просто ДНК-содержащей плазмой (рис. 43).
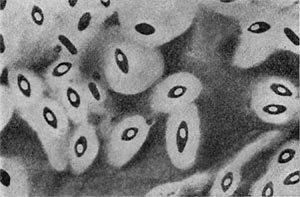
Рис. 42. Капсулы вокруг клеток Clostridium. Увел. X 2200.
Цитоплазма анаэробов имеет состав и строение, аналогичное цитоплазме аэробов. В цитоплазме некоторых анаэробов содержатся включения запасного питательного вещества гранулезы — крахмалоподобного полисахарида. При окраске йодом в растворе Люголя гранулеза приобретает синеватую или буро-коричневую окраску. На ультратонких срезах это вещество можно увидеть в форме светлых шаровидных включений (рис. 45). Липидные тельца (капли поли-в-оксимасляной кислоты) в цитоплазме облигатных анаэробов встречаются редко.
Спорообразование у анаэробных бактерий
Споры представляют собой специфическим образом устроенные покоящиеся зародышевые клетки, выдерживающие влияние высокой температуры, радиации, вакуума, различного рода токсических веществ и других неблагоприятных факторов, приводящих к гибели вегетативные клетки.
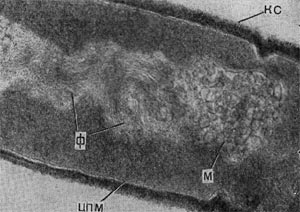
Рис. 43. Ультратонкпй срез клеток Clostridium penicillum. Видны клеточная стенка (КС), нуклеопд со спирально закрученными фибриллами ДНК(Ф), связанные с нуклеоидом мезосомы (М), п цптоплазматическая мембрана (ЦПМ).
Секрет их необычной устойчивости давно интригует ученых, и в последние годы во многих странах развернулись интенсивные исследования процесса спорообразования.
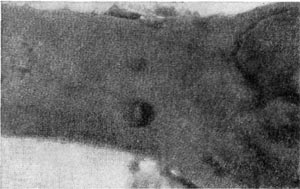
Рис. 44. Ультраструктура клеточной стенки у Clostridium sp. Увел. X 45 000.
Бактериальные споры образуются эндогенно, т. е. внутри материнских вегетативных клеток. Что заставляет бактерии перейти от вегетативного размножения к спорообразованию? Формирование спор наступает на определенной стадии развития в тот момент, когда в среде исчерпываются пищевые ресурсы (прежде всего источники углерода и азота) и происходит накопление токсичных продуктов обмена веществ. Каков же конкретный пусковой механизм, включающий процесс спорообразования? На этот вопрос ответа пока нет.
Основное назначение спорообразования перевести культуру в покоящееся (анабиотическое) состояние. Действительно, у зрелых спор обмен веществ находится на крайне низком уровне. Это позволяет бактериям сохраниться при неблагоприятных условиях среды, а при изменении условий в благоприятную сторону снова перейти к вегетативному росту. Для анаэробов (особенно почвенных) крайне важно также, что споры не чувствительны к кислороду. Это позволяет им выжить в аэробных условиях, губительно действующих на вегетативные клетки. Способность бактерий образовывать споры позволяет им оставаться жизнеспособными в течение десятков и сотен лет. Жизнеспособные споры были выделены из египетских мумий, трупов мамонтов и других объектов, где они провели века и тысячелетия.
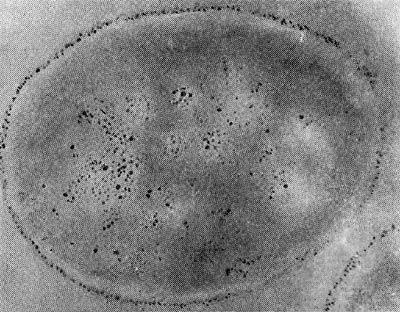
Рис. 45. Включения гранулезы в клетках Clostridium taeniosporum. «Окраска» полисахаридов серебром. От ложения зерен серебра видны в светлых шаровидных включениях и в клеточной стенке. Увел. X 45 000.
Таким образом, споры служат целям сохранения вида.
Цитология спорообразования
Молодые интенсивно делящиеся клетки анаэробов содержат нуклеоиды в виде гантелек, или V-образных фигур (рис. 46). Перед спорообразованием деление клеток прекращается, они резко увеличиваются в размерах. В это время происходит накопление большого количества запасного питательного вещества — гранулезы, — откладывающегося в виде гранул, из-за чего цитоплазма становится зернистой, а сами клетки раздуваются, принимая вид лимона (клостри-дии) (рис. 47—49) либо барабанной палочки (плектридии) (рис. 50, 51). Лишь у части протеолитических анаэробов клетки не меняют своего первоначального вида, сохраняя обычную палочковидную (бациллярную) форму (рис. 52).
Первым признаком наступления спорообразования является изменение морфологии ну-клеоидов, принимающих вид шаровидных телец. Далее несколько нуклеоидов сближаются на одном из полюсов клетки, сливаются и образуют продольно расположенный извитый хроматиновый (ядерный) тяж (рис. 53, 54 и схема 1 на табл. 32).
Зона цитоплазмы, в которой расположен ядерный тяж, превращается далее в п р о-спору. У бактерий с мелкими клетками перед спорообразованием имеются обычно 2 отдельных нуклеоида, которые сливаются с образованием осевой хроматиновой нити. Впоследствии только часть этой нити переходит в спору. Третий тип поведения ядра встречается у многих сахаролитических анаэробов. Ядерное вещество у них имеет вид хроматиновой сеточки, расположенной по всей цитоплазме. Часть этой сеточки стягивается на одном из полюсов клетки с образованием тяжа — центра формирующейся просторы. С помощью обычного микроскопа можно выделить три стадии формирования споры. Первая — возникновение на одном из полюсов клетки спо-рогенной зоны, в которой хорошо заметно ядерное вещество в виде светлых палочек (рис. 39). Вторая — спорогенная зона превращается в темную (оптически плотную) овальной формы проспору с четко выраженными контурами. В проспорах ядерное вещество уже не выявляется без применения специальных методов (окрашивание). Третья — проспоры постепенно светлеют, приобретая способность сильно преломлять свет, и теряют способность окрашиваться красителями. Созревшие споры выглядят светлыми, резко преломляющими свет тельцами, обладающими мощной оболочкой (рис. 40). Форма зрелых спор может быть различной у разных видов анаэробов: сферическая, овальная, яйцевидная, цилиндрическая.
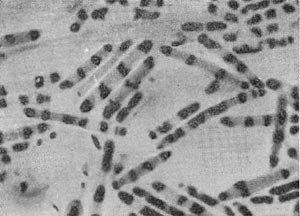
Рис. 46. Молодые, интенсивно делящиеся клетки С1оstridium sporopenitum. Видны делящиеся нуклеоиды. Окраска ядерного вещества по методу Романовского — Гимза. Увел. X 3500.
В люминесцентном микроскопе при окраске акридиновым оранжевым (люминесцирующий краситель) наблюдается многокрасочное изображение. Вегетативные клетки светятся (люминесцируют) слабым зеленоватым светом. Их ядра ярко люминесцируют зеленым светом (табл. 32, схема 1). Ядерные тяжи в спорогенной зоне сначала зеленые, затем окружаются веществом с красной флюоресценцией. Далее флюоресцирующая красная зона принимает овальную форму, а хроматиновый, расположенный в центре тяж светится желтым светом. При созревании спора резко меняет цвет и начинает светиться ярким зеленым светом. У зрелых спор с хорошо выраженным кортексом (корой) сердцевина споры темная, зеленым светится только оболочка. Меняется также и цвет цитоплазмы материнской клетки (спорангия). Сначала она слабо-зеленого цвета, затем, с момента оформления проспоры, начинает светиться оранжевым светом.
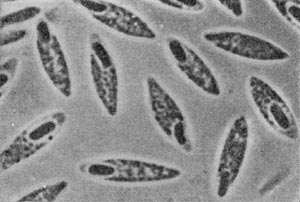
Рис. 47. Клострнднальная форма клеток Clostridium butyricum. Увел. X 3500.
Хроматиновое вещество сначала выглядит в виде компактных шаровидных гранул, а при созревании проспоры заметно разрушение нуклеоидов.
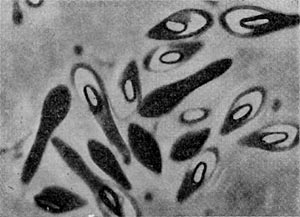
Рис. 48. Клостридиальная форма клеток. Споры снабжены светлыми конусовидными колпачками. Clostridium species, шт. 1. Увел. X 3500.
Биологическое значение слияния ядерного вещества перед спорообразованием остается неясным. Слияние хроматина наблюдается и у неспорулирующих вегетативных клеток под влиянием антибиотиков, низкой температуры, высоких концентраций солей и т. д. Во всех этих случаях, как и при спорообразовании, происходит остановка или резкое снижение синтеза ДНК. Отсюда некоторые исследователи делают вывод об отсутствии специфического значения слияния ядерного вещества перед спорообразованием. Другие авторы считают, что подобное поведение ядра имеет определенный генетический смысл. Интересно, что не только цитологические, но и химические анализы также свидетельствуют о необычном поведении ДНК при спорообразовании. Например, в спорах анаэробов нуклеотидный состав ДНК смещается по сравнению с ДНК вегетативных клеток в сторону ГЦ-типа (ДНК в спорах более «богата» такими основаниями, как гуанин и цитозин). Для спорообразующих аэробов, кроме того, показано, что около 40% высокополимерной ДНК перед спорообразованием выделяется из клеток в среду (редукция части хроматина).
Электронная микроскопия с ее высокой разрешающей способностью открывает много новых деталей процесса спорообразования. Нужно иметь в виду, что принципы формирования изображения в электронном и обычном световом микроскопе значительно отличаются: в обычном используется видимый свет (фотоны), а в электронном — поток отрицательно заряженных частиц — электронов.
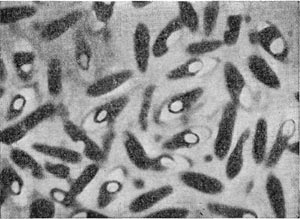
Рис. 49. Клострпдиальная форма клеток при спорообразовании. Споры со светлыми конусовидными колпачками. Clostridium sp. Увел. X 3500.
Эти различия необходимо учитывать, чтобы правильно оценивать электронно-микроскопические снимки. В обычном микроскопе изображение создается главным образом за счет различий в степени поглощения света разными участками исследуемого объекта, в электронном — в основном за счет рассеяния объектом электронов. Проходя через объект, электроны сталкиваются с атомными ядрами, рассеиваются и задерживаются. Только та часть электронов, которая беспрепятственно пройдет через объект и попадет на флюоресцирующую пластинку (экран микроскопа), сможет создать изображение. Те места на экране, куда попадут электроны, будут светиться. То есть участки клеток, сильно рассеивающие электроны, будут выглядеть на экране .темными, а участки, слабо рассеивающие электроны,— светлыми.
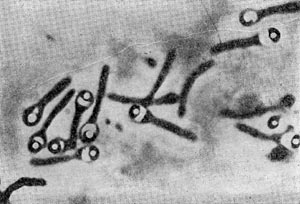
Рис. 50. Плектриндиальная форма клеток при спорообразовании. Споры с серповидными колпачками. Clostridium sp. Увел. X 3500.
Биологические объекты (клетки) состоят из веществ, построенных главным образом из легких элементов (С, N, О, Н, Р, S и др.), поэтому их изображение в электронном микроскопе слабо контрастно — в клетках можно увидеть очень мало структурных деталей. При использовании светового микроскопа это затруднение преодолевается при помощи окрашивания (контрастирования) объектов различными красителями. В электронном микроскопе изображение одноцветное. Чтобы сделать изображение более контрастным, клетки обрабатывают солями тяжелых металлов (свинца, ртути, хрома, урана, вольфрама). Так как атомы тяжелых металлов очень сильно рассеивают электроны, то структуры клетки, поглотившие эти металлы, будут выглядеть темными и контрастными. Соли тяжелых металлов или их окислы принято теперь называть электронными красителями.
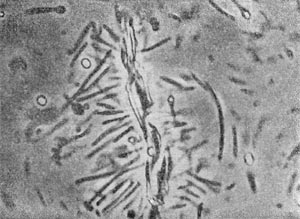
Рис. 51. Плектридтти, адсорбированные на целлюлозном волокне. (Клетчаткоразрушающне бактерии.) Увел. X 3500.
Электронную микроскопию в настоящее время нельзя рассматривать только как более утонченный морфологический метод, так как при описании электронно-микроскопических изображений цитологи неизбежно переходят с описания формы на язык химии и физической химии и пытаются объяснить на молекулярном уровне строение и функцию тех или иных структур клетки. Поэтому морфология, «спустившись на субмикроскопический уровень, органически срастается с биохимией и физиологией клетки» (Г. М. Франк).
Целые клетки из-за своей большой толщины непрозрачны для пучка электронов. Поэтому, чтобы выявить внутреннюю структуру, бактериальную клетку разрезают на десятки и даже сотни отдельных ломтиков (срезов) толщиной всего 200—600 А. Далее эти срезы просматривают в микроскопе.
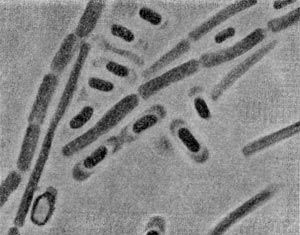
Рис. 52. Бациллярный тип спорообразования у С1оstridium sporopenatum. Увел. X 3500.
Электронно-микроскопические исследования ультратонких срезов спорулирующих клеток бактерий показали, что формирование проспо-ры начинается с инвагинации (врастания) цитоплазматическоп мембраны ближе к одному из полюсов клетки (схема 2 на табл. 32). При этом мембрана продвигается к центру клетки, и полюса ее сливаются с образованием споровой перегородки (септы). В этом процессе участвуют мезосомы, которые как бы спаивают сближающиеся участки инвагинированных мембран (рис. 1 на табл. 33). Септа состоит из двух элементарных мембран. На этом заканчивается вторая стадия спорообразования (если за первую принять образование хроматинового тяжа). Эту стадию можно рассматривать как модифицированное клеточное деление, которое, как известно, также происходит благодаря инвагинации цитоплаз-матической мембраны и образования септы.
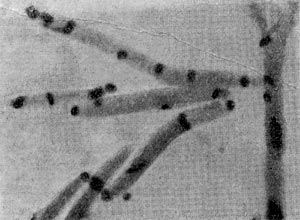
Рис. 53. Слияние нуклеоидов на полюсах клеток (перед спорообразованием). Clostridium sporopenitum. Увел. X 3500.
Следующей стадией является процесс «поглощения» материнской клеткой септированного (отсеченного) участка цитоплазмы с ядром. Этот процесс осуществляется путем роста и продвижения периферических участков мембраны материнской клетки по направлению к полюсу клетки. Затем сближающиеся участки мембраны сливаются и образуется проспора, обладающая двумя элементарными (трехслойными) мембранами — внутренней и внешней (рис. 2 на табл. 33). У одних видов проспора остается в дальнейшем у полюса клетки (терминальное расположение), у других она перемещается внутрь цитоплазмы, занимая центральное либо субтерминальное положение. Таким образом, в конце этой стадии образуется своеобразный двуклеточный организм: внутри цитоплазмы материнской клетки возникает новая клетка — проспора, окруженная, в отличие от материнской, двумя элементарными мембранами. С этого момента начинается новая необратимая фаза развития и метаболизма, заканчивающаяся созреванием споры и гибелью материнской клетки.
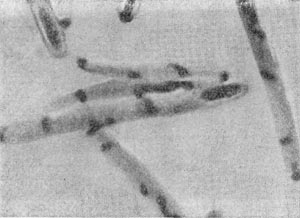
Рис. 54. Образование ядерных тяжей в процессе спорообразования. Clostridium sporopenilum. Увел. X 3500.
Интересно, что, в отличие от четвертой, вторая и частично третья стадии спорообразования обладают еще свойством обратимости. Так, если после образования септы добавить к спорулирующей культуре антибиотик хлорамфеникол, то синтез белков (а значит, и рост мембраны) будет подавлен. Движение периферических участков мембраны, поглощающей отсеченный участок протопласта, будет остановлено. В результате начавшийся процесс спорообразования превратится в обычный процесс вегетативного деления клеток, и между двумя мембранами септы отложится материал клеточной стенки (рис. 55), чего не бывает при нормальном течении спорообразования. Считается, что на четвертой стадии споруляции происходит образование кортикального слоя (кор-текса) между внутренней и внешней мембранами проспоры. Сначала кортекс появляется в виде тонкого темного слоя, сходного по структуре и плотности с клеточной стенкой вегетативной клетки. Затем этот слой резко увеличивается в толщине за счет образования более электронно-прозрачного (светлого) слоя (рис. 2—5 на табл. 33).
На пятой стадии закладывается оболочка споры. Вначале вокруг проспоры на некотором расстоянии от внешней мембраны проспоры в цитоплазме материнской клетки возникают участки темного (электронно-плотного) вещества в виде чешуек. На шестой стадии отдельные листки оболочки удлиняются и, в конце концов, сливаются, образуя сплошной непрерывный плотный слой. Между этим слоем и внешней мембраной проспоры остается отсеченный слой цитоплазмы вегетативной клетки. Поверх первого слоя оболочки может закладываться еще один или два слоя. В этом случае они разделяются на внутренний, средний и внешний слои оболочки. Эти слои различаются между собой по структуре. У некоторых видов внутренний слой оболочки является пластинчатым, а внешний имеет вид плотного толстого слоя. У других видов, наоборот, пластинчатый слой может быть внешним, а более плотный слой — внутренним. Если строение сердцевины очень сходно у разных видов, то строение оболочек спор у них сильно различается как по тонкому строению, так и по количеству и толщине слоев (рис. 56).
После окончательного созревания споры происходит лизис материнской вегетативной клетки — клеточная стенка разрушается, и спора выходит в среду (седьмая стадия).
У многих видов анаэробов поверх споровой оболочки обнаруживается еще одна структура — экзоспориум. Он имеет вид чехла, в котором расположена спора (рис. 57). Тонкое строение экзоспориума весьма различно у разных видов (рис. 56). Часто он очень многослоен, например у Clostridium pasteurianum, Cl. bifermentans, Cl. tyrobutyricum и др. В экзоспориуме многих видов анаэробов обнаруживаются слои с упорядоченно расположенными субъединицами. На рисунке 58 показана тонкая структура пластинчатого слоя экзоспориума. Шаровидные субъединицы в этом слое имеют гексагональную упаковку. Иногда рядом расположенные субъединицы сливаются, образуя кольцевидные структуры с порами в центре. Такие слои экзоспориума представляют собой перфорированные пленки-мембраны. Возникает экзоспориум на ранней стадии формирования споры в виде небольшого пузырька на внешней мембране проспоры. Этот пузырек разрастается, превращаясь в чехол, охватывающий спору со всех сторон.
У анаэробов этот чехол не цельный, имеет крупные поры. Иногда через эти поры в цитоплазму спорангия проходят трубчатые выросты споровой оболочки.
Химический состав и роль споровых структур. Сердцевина споры, окруженная слоем кортекса, представляет собой протопласт с собственной мембраной, ядром и цитоплазмой (схема 3 на табл. 32). Сердцевина у зрелых спор является покоящейся вегетативной клеткой. Она характеризуется очень низким уровнем метаболизма. Хотя в ней имеются все необходимые ферменты, их активность каким-то образом подавлена.
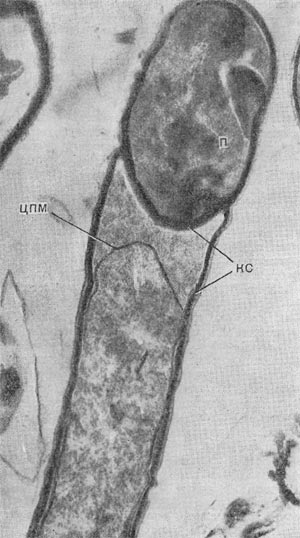
Рис. 55. Влияние хлорамфеникола (антибиотика, подавляющего синтез белка) на спорообразование. Остановка на стадии образования септы п превращение спорообразования в процесс вегетативного деления клеток. Увел. X 66 000. Clostridium penicillum. П — проспора, ЦПМ — цитоплазматическая мембрана, КС — клеточная стенка. Увел, х 66 000.
Кортекс (схема 3 на табл. 32) состоит из мукопептидов, весьма сходных с мукопептида-ми клеточных стенок. В кортексе содержится также диаминопимелиновая кислота. Внутренняя плотная часть кортекса, прилегающая к мембране сердцевины, при прорастании спор оформляется в клеточную стенку молодой вегетативной клетки. В спорах обнаруживается в довольно больших количествах дипиколино-вая кислота (C7H5O4N) — активный хелирующий агент, соединение, образующее клешневидные комплексы с металлами. Это вещество отсутствует в вегетативных клетках. Из спор дипи-колиновая кислота выделяется в виде кальциевой и магниевой солей, играющих большую роль в термоустойчивости спор. Хорошо известно, что споры способны выдерживать высокие температуры и не погибают даже при кипячении. Имеются также доказательства того, что дипиколиновая кислота играет центральную роль в процессе перевода протопласта споры в покоящееся состояние. Но механизм этих явлений не выяснен. Предполагается, что дипиколиновая кислота локализована в кортексе, так как имеется определенная корреляция между образованием кортекса и накоплением в споре дипиколиновой кислоты и кальция. С другой стороны, при разрушении кортекса (в процессе прорастания или механическом разрушении спор) дипиколиновая кислота обязательно переходит в раствор.
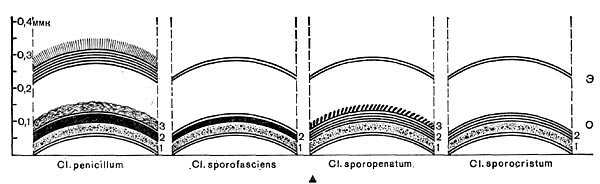
Рис. 56. (Схема.) Строение оболочки спор у различных видов анаэробных бактерий: Э — экзоспориум, О — оболочка споры. 1, 2, 3 — слои споровой оболочки.
Кортекс у зрелых спор, очевидно, играет защитную роль. Он предохраняет сердцевину от литических ферментов, разрушающих клетки. Это предположение подтверждается экспериментами с мутантами, у которых потеряна способность к формированию кортекса. На завершающей стадии спорообразования происходит резкое возрастание активности литических ферментов, полностью разрушающих материнскую вегетативную клетку. Лишенные кортекса споры при этом также лизируются.
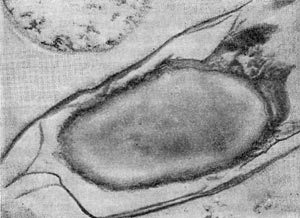
Рис. 57. Зрелая спора Clostridium penicillum. Сердцевина выглядит бесструктурной. Видны многослойный экзоспорпум п выросты на оболочке споры. Увел. X 45 000.
Оболочка (или покровы) является уникальной структурой бактериальных спор, не встречающейся у других микроорганизмов (схема 3 на табл. 32). Она в основном состоит из белковых веществ, обогащенных цистином. Объем оболочки достигает 50% от всего объема споры. Вещество споровых оболочек не чувствительно к действию различных литических ферментов. Специфическая для каждого вида бактерий форма спор сохраняется благодаря структурной ригидности оболочек. Оболочка играет также роль защитной структуры, предохраняющей споры от преждевременного прорастания. Споры мутантных штаммов, лишенные оболочек, обычно прорастают непосредственно после выхода из спорангиев в неблагоприятной для роста среде (даже в дистиллированной воде), что приводит к гибели проросшие клетки. Однако роль оболочек спор, так же как и кортекса. остается во многом еще загадочной.

Рис. 58. Тонкая структура экзоспориума у Clostridium bifermentans. Видны отдельные светлые субъединицы и гексагональные «плитки». Увел. X 384 000.
Экзоспориум представляет собой мембрано-видную, часто многослойную структуру. Химический состав экзоспориума проанализирован лишь у одной аэробной культуры. О составе экзоспориума у анаэробов данных в литературе нет. Предполагается, что экзоспориум играет роль барьера, регулирующего проникновение различных веществ в спору. В этом отношении необъясненным остается тот факт, что у многих анаэробных бактерий экзоспориум не представляет собой замкнутой системы: в его полярной части, погруженной в цитоплазму материнской клетки, имеются очень крупные поры, или отверстия, диаметром до 0,5 мкм. Некоторые авторы предполагают, что экзоспориум участвует в формировании споровых оболочек. После механического удаления экзоспориума споры остаются нормальными, процесс прорастания у них не нарушается. Роль экзоспориума продолжает оставаться загадкой.
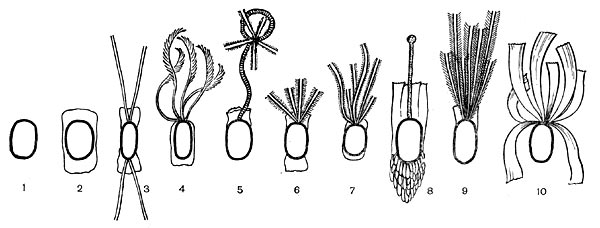
Рис. 59. Строение поверхностных структур спор некоторых анаэробных бактерий: Споры без выростов и экзоспориума: 1 — Clostridium felsincum. Споры с экзоспориумом в, виде чехла: 2 — Cl. pasteurianum. Споры с выростами различных типов и экзоспориумом: 3 — Cl. sporosetosum; 4 — Cl. sporopenatum; s — Cl. saprogenes; 6 — Cl. sporofasciens; 7 — Cl. sartagoformuin; s — Cl. corinoforum; 9 — Cl. penicillum. Споры с лентовидными выростами, но без экзоспориума: 10 — Cl. taeniosporum.
Выросты на спорах. Замечательной особенностью спорообразования у анаэробов является формирование на спорах особых выростов с поразительно разнообразной структурой. Каждому виду анаэробных бактерий свойствен свой тип строения выростов (рис. 59). Этот признак строго специфичен, наследственно закреплен и очень устойчив. Даже у дефектных спор, потерявших способность образовывать оболочку, выросты сохраняются и не меняют своей специфической структуры.
Поражает разнообразие выростов у различных видов анаэробных бактерий. Они могут иметь форму метелок, тонких нитей или жгутиков, трубок различной толщины, разбросанных по всей поверхности споры или собранных в пучок ершиковидных палочек, длинных широких лент, шипов, булавок и образований, сходных по форме с оленьими рогами (табл. 34).
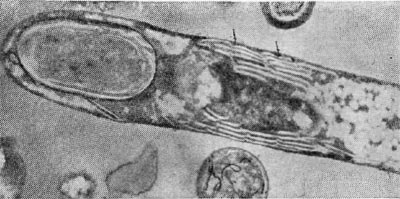
Рис. 60. Ультратонкий срез клеток Cl. taeniosporum. Реакция на дегидрогеназы. Стрелками показаны отложения теллура. Видны выросты п светлые шаровидные включения гранулезы. Увел. X 45 000.
У Clostridium taeniosporum выросты имеют лентовидную форму. Пучок таких отростков прикрепляется к споре с помощью специального органа — подушечки (схема 3 на табл. 32 и рис. 4 на табл. 35). Выросты появляются на ранней стадии формирования проспоры - перед закладкой кортекса и оболочки; затем они растут, удлиняются, пронизывая цитоплазму, пока не достигнут противоположного полюса клетки. Цитоплазма вокруг выростов постепенно лизируется (рис. 61). Материнская клетка разрушается. На свободных зрелых cпорах, вышедших из спорангия, выросты распускаются в виде зонтика (рис. 3 на табл. 34).
Рис. 61. Поперечный ультратонкнй срез клеток С1. penicillum. Хорошо заметен лизис цитоплазмы вокруг трубчатых выростов (светлые зоны). Увел. X 96 000.
На спорах Clostridium saprogenes имеется по одному крупному и сложноустроенному выросту (табл. 35). Он имеет вид длинного толстого жгута-ствола, образующего на конце кольцо, от которого отходят усики — трубчатые палочковидные отростки. Ствол имеет грубозернистую структуру и поперечную исчер-ченность, мелкозернистые усики обладают кап-сулярным слоем. Формирование выростов у этого вида можно проследить на целых клетках. Сначала отростки плохо просматриваются, так как они окружены плотными участками цитоплазмы (рис. 1 на табл. 35), затем цитоплазма осветляется и выросты становятся хорошо заметными (рис. 2 на табл. 35). На одном из полюсов клетки четко заметна кольцевидная структура и усики.
Рис. 62. Ячеистые колпачки на спорах. Видны отдельные газовые вакуоли (мешочки), составляющие колпачок. Cl. caliptrosporum. Увел. X 55 000.
Следующая стадия — лизис материнской клетки и выход зрелой споры в среду (рис. 3 на табл. 35). У организма, описанного как Bacillus (Clostridium) penicillus (строгий анаэроб), выросты имеют вид пучка толстых трубок, прикрепленных к одному из полюсов споры (рис. 1 на табл. 34). На поперечных срезах спорулирующих клеток четко видны зоны лизиса цитоплазмы вокруг выростов, имеющих вид овальных плотных телец с зернистой структурой (рис. 61).
Химической состав и роль выростов на спорах.
Сложные по строению отростки на спорах впервые были обнаружены сотрудниками кафедры биологии почв Московского университета. В настоящее время выросты на спорах анаэробов изучаются также во многих лабораториях за рубежом. Описываются новые виды отростков. Наиболее интересным является вопрос о функции (биологической роли) этих споровых структур. Выяснение функции тех или иных клеточных структур — отнюдь не легкое дело. В истории биологии найдется немало примеров тому, что выяснение роли той или иной клеточной структуры занимает много лет (а иногда и десятилетий). Подобные исследования очень увлекательны и имеют большое значение: с каждой новой структурой открываются новые вещества, особые ферменты, нередко совершенно неизвестные биохимические процессы.

Таблица 34. Спорообразующие анаэробные бактерии: 1 — Clostridium penicillum, трубчатые выросты на спорах; 2 — Cl. sporotrichum, жгутиковидные отростки на спорах; 3 — Cl. taeniosporum, лентовидные выросты на спорах; 4 — Cl. sporopenatum, перистые выросты на спорах; 5 — Cl. sartagoformum, трубчатые выросты на спорах; 6 — Clostridium sp., споры с шипами на поверхности оболочки.
Функция выростов на спорах окончательно еще не выяснена. Одни исследователи предполагают, что отростки на спорах — специфические чувствительные (хемосенсорные) органел-лы, подающие споре «команду» на прорастание (при благоприятных условиях). Другие считают, что выросты выполняют важную роль в процессе созревания спор, участвуя в формировании споровых покровов и кортекса. Третьи допускают, что выросты на спорах — результат каких-то нарушений в нормальном обмене веществ.
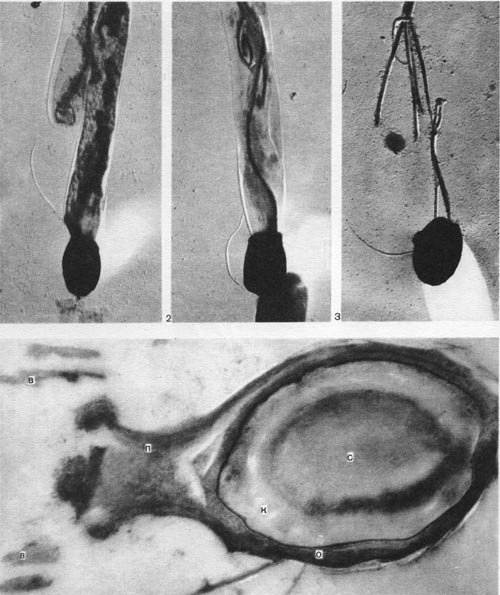
Таблица 35. Спорообразующие анаэробные бактерии: 7, 2, 3, — Clostridium saprogenes, выросты в виде султана, разветвляющегося на конце. Видны стадии формирования споры и выростов, заканчивающиеся лизисом клетки и освобождением споры (1, 2 — увел, х 10 800; 5 -— увел, х 15 000); 4 — Cl. taeniosporum, срез споры с лентовидными выростами; видна подушечка, прикрепляющая выросты к споре: п — подушечка, в — выросты, с — сердцевина споры, о — оболочка, к — кортекс.
Химические анализы показали, что выросты состоят в основном из белка. В веществе выростов обнаружено 18 различных аминокислот, а также полисахариды и липиды. Оказалось, что по аминокислотному составу и структуре белок выростов сходен с такими белками, как кератин, актин, коллаген. Для того чтобы проделать подобные анализы, нужно было «отрезать» выросты у большого количества спор, а затем очистить от загрязняющих веществ и собрать их вместе. В качестве «ножниц» при этом был использован ультразвук, а собрать микроскопические отдельные отростки удалось с помощью современных высокоскоростных центрифуг.
Очень важным является вопрос о ферментативной активности выростов. В трубчатых выростах Bacillus penicillus выявлена дегидро-геназная активность (т. е. активность ферментов, отщепляющих водород от окисляемых субстратов).
Химический состав и тонкая структура выростов, их локализация в области контактирующих мембран двух функционально различных клеток (материнской клетки и проспоры) позволяют в общем виде заключить, что выросты бактериальных спор представляют собой специализированные структуры, которые ответственны за контакт клеток в системе спорангий — спорта.
Колпачки на спорах
Еще одной чрезвычайно интересной особенностью спорообразования у анаэробов является формирование на спорах блестящих колпачков. Эти колпачки на спорах у клостридиального и бациллярного типа клеток имеют конусовидную, а на спорах плектри-диев — серповидную форму (рис. 48—50, 62). Колпачки при наблюдении в фазово-контраст-ном микроскопе четко выделяются благодаря сильному блеску. Электронная микроскопия показывает, что они имеют ячеистое строение. Множество отдельных ячеек упакованы таким образом на споре, что образуют сотовидную структуру в виде конуса или серпа. Ячейки - это электронно-прозрачные мешочки, заполненные газообразным веществом (газовые вакуоли). Мешочки имеют палочковидную или яйцевидную форму (см. рис. 62). Назначение колпачков состоит, по-видимому, в том, чтобы увеличивать подвижность и плавучесть спор в водной среде, и тем самым способствовать их распространению в природе. Подобно понтонам ячеистые колпачки не позволяют спорам тонуть. Споры с колпачками не удается осадить даже с помощью центрифуг, более того, при центрифугировании они всплывают на поверхность.
Способностью образовывать ячеистые колпачки обладают азотфиксирующие сахаролити-ческие клостридии, сульфатредуцирующие бактерии и специфические почвенные плектридии, распространенные главным образом в почвах гидроморфного ряда.
Физиология спорообразования у анаэробов
Причины, вызывающие переход бактерий от вегетативного развития к спорообразованию, длительное время были неизвестны микробиологам. Впервые в нашей стране А. Я. Мантеифель, Н. Д. Иерусалимский провели исследования, вскрывшие факторы, влияющие на образование спор сахаролитическими анаэробами. Оказалось, что спорообразование вызывается исчезновением из среды источников азота, а также накоплением продуктов обмена (например, бутилового спирта). Но чтобы приобрести способность к споруляции, бактерии должны развиваться при нормальных условиях на полноценной питательной среде, содержащей набор аминокислот и факторов роста. Кислотность среды, оптимальная для вегетативного роста, является наиболее благоприятной и для спорообразования (рН 4,5—5,5 для Cl. acetobutylicum и ~7—7,2 для протеолитических анаэробов). Аэрация останавливает споруляцию. Эти данные свидетельствуют о том, что спорообразование является нормальной стадией развития у этих бактерий.
У анаэробов в отличие от аэробных видов исчерпание в среде источников углерода не влияет на процесс спорообразования. Даже добавление к среде глюкозы (5 г на литр) не сказывается на процессе спорообразования. Если культура выращена на полноценной питательной среде и приступила к спорообразованию, то дальнейший перевод клеток в условия полного голодания (например, перенос в водопроводную воду) не только не подавляет, но даже стимулирует споруляцию у некоторых сахаролитических анаэробов (Cl. saccharobutyricum), т. е. для спорообразования не требуется в этом случае поступления питательных веществ из внешней среды (экзогенных источников питания), а для завершения конечных этапов формирования спор используются внутриклеточные запасы. Такой обмен веществ называется эндогенным (или эндотрофным) метаболизмом. Действительно, установлено, например, что белок спор образуется за счет азота белка вегетативных клеток. Однако у протеолитических анаэробов споруля-ция не поддерживается в среде, полностью лишенной органических питательных веществ. Так, для спорообразования Cl. botulinum требуются аминокислоты — аланин и аргинин, которые используются в качестве источников энергии.
>Генетический контроль спорообразования.
Процесс «поглощения» материнской клеткой от сеченной на полюсе части цитоплазмы с ядерным элементом приводит к образованию новой клетки с двумя мембранами (проспора). Возникает особая ассоциация клеток — двуклеточ-ный организм в общей оболочке, причем одна из клеток — проспора осуществляет свою жизнедеятельность внутри цитоплазмы другой, материнской клетки. Возникает крайне интересная ситуация, где сталкивается деятельность двух генетических центров — ядра материнской клетки и ядра споры. Многие стороны в их взаимоотношениях остаются еще неясными. Но из цитологических, физиологических и генетических наблюдений можно сделать вывод, что эти два ядра «разделяют» между собой обязанности, связанные с контролем над процессами формирования споровых структур.
Рис. 63. Стадии прорастания спор Cl. sporopenitum. Увел. X 2100.
Так, синтез новых белковых веществ, споровых оболочек, кортекса и экзоспориума осуществляется при активном контроле генома материнской клетки. При этом роль материнской клетки сводится к тому, чтобы как-то отделить от себя дочернюю клетку, оказавшуюся внутри ее цитоплазмы. Но так как удалить проспору за пределы клеточных границ через цитоплазматическую мембрану и клеточную стенку невозможно, то материнская клетка поступает с дочерней по-иному — она изолирует ее от себя путем инцистирования, окружая проспору мощными слоями белковой оболочки и переводя ее в метаболически неактивное (анабиотическое) состояние. Но это все равно не спасает материнскую клетку от гибели. Хотя она и продолжает еще длительное время активно функционировать, даже иногда способна образовать еще одну спору, но все же она не в состоянии вернуться к вегетативному развитию. В результате нарушения обмена веществ в конце концов наступает лизис (разрушение) вегетативной материнской клетки и освобождение спор.
Участие в спорогенезе большого количества ферментов и антигенов, включение новых путей биосинтеза и появление новых специфических клеточных структур показывает, что число генов, контролирующих спорогенез, достаточно велико (по всей вероятности, их больше 100). Некоторые из этих генов функционируют и в период вегетативной стадии развития. До сих пор остается неясным механизм функционирования спорового генома (набора генов, ответственных за спорообразование). Установлено, что споры получают весь свой ядерный материал (ДНК) в готовом виде от материнских клеток. При этом количество ДНК на спору постоянно для данного вида и не зависит от среды выращивания бактерий. Таким образом, этот показатель, вероятно, может служить характеристикой вида и использоваться при систематике спорообразую-щих бактерий.
Прорастание спор
Споры, перенесенные в свежую питательную среду, начинают прорастать. Сначала они набухают, темнеют, затем через образовавшееся отверстие в оболочке споры молодая клетка выходит в среду. При этом слой кортекса разрушается, а споровая оболочка вместе с отростками (если таковые имеются) сбрасывается. У анаэробов проследить за прорастанием, наблюдая за одной и той же спорой, удается только в редких случаях. На рисунке 63 представлена серия фотографий, иллюстрирующих различные стадии прорастания — от потемнения сердцевины спор до выхода молодой вегетативной клетки из споровой оболочки. На последней стадии выхода вегетативная клетка как бы отстреливается. Отверстие в оболочке споры образуется не строго на полюсе споры, а несколько сбоку, и молодая вегетативная клетка при выходе расположена под углом к длинной оси споры. У других анаэробов процесс прорастания может выглядеть иначе.
Особенности прорастания Cl. pasteurianum С. Н. Виноградскии (1902) использовал для дифференциации этого вида от других спорообразующих анаэробов. Наконец, три вида клостридиев — Cl. pectinovorum, Cl. bu-tyricum и Cl. tetani — отличаются тем, что прорастание их спор происходит внутри спорангия. Клеточная стенка (или часть ее) у этих видов не лизируется, а остается на зрелых спорах, облегая их в виде чехла. Но этот чехол не идентичен по происхождению и строению с экзоспориумом, описанным выше.
Цитологические особенности спорообразующих анаэробов
Морфология и тонкое строение клеток анаэробных бактерий изучены еще слабо. Скудность морфологии клостридиев отмечалась многими микробиологами, изучавшими эту группу микроорганизмов. Лишь в последнее время с помощью фазово-контрастной и главным образом электронной микроскопии получены новые данные по цитологии анаэробов.
Принципиальных отличий в строении клеток анаэробов (в сравнении с аэробными организмами) не найдено. Однако некоторые группы спорообразующих анаэробов имеют определенные цитологические особенности. Так, анаэробные клостридии в отличие от аэробных споро-образующих бактерий не содержат липидных включений — гранул полибетагидроксибутирата (Имшенецкий, 1944). Вместо них у клостридиев и некоторых плектридиев накапливается гранулеза (крахмалоподобное соединение). И еще одной особенностью анаэробов, о которой упоминалось выше, является формирование на спорах анаэробов специфических выростов и ячеистых колпачков.
Физиологические и биохимические особенности спорообразующих анаэробных бактерий
Главные отличия анаэробов касаются энергетического метаболизма, т. е. реакций, снабжающих организм энергией, и ферментов, связанных с этими реакциями. Сущность анаэробиоза была кратко и в то же время точно сформулирована Луи Пастером как «жизнь в отсутствие воздуха», т. е. жизнь без дыхания, существующая за счет анаэробного превращения веществ.
Анаэробиоз свойствен и факультативно анаэробным микроорганизмам. В отличие от последних облигатные анаэробы не могут развиваться в присутствии кислорода, более того, кислород в молекулярной форме ядовит для анаэробов.
Как известно, микроорганизмы черпают энергию, необходимую для поддержания их жизнедеятельности, за счет различного рода процессов окисления органических (а иногда и неорганических) веществ. При этом окисление происходит путем отщепления от субстратов водорода (или электронов). Водород переносится по цепи ферментов и в конечном итоге соединяется с кислородом, образуя воду. Анаэробный же способ извлечения энергии характеризуется тем, что свободный кислород в нем не принимает участия, а органические субстраты окисляются только за счет отщепления водорода. Освобождающийся водород либо присоединяется к продуктам распада того же самого органического вещества, либо выделяется в газообразном состоянии.
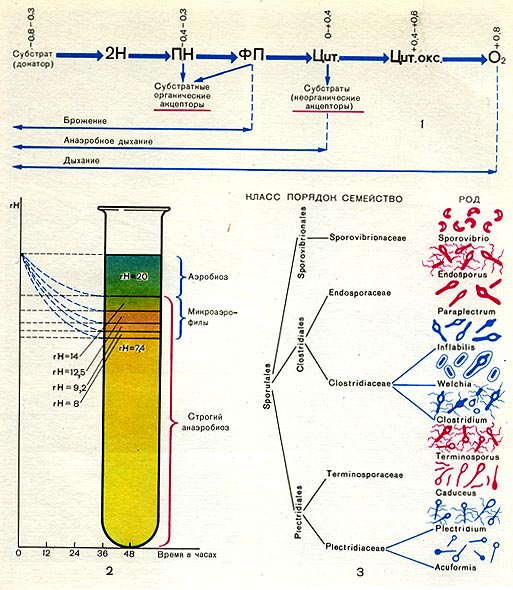
Таблица 36. Спорообразующие анаэробные бактерии.
На схеме 1 (табл. 36) показан транспорт электронов при дыхании и различных типах анаэробного способа получения энергии. Водород и электроны отщепляются от субстратов с помощью пиридиннуклеотидных ферментов (ПН). Далее они у аэробов проходят по цепи ферментов с возрастающими потенциалами — флавопротеидные (ФП)—цитохромные ферменты (Цит.) - и с помощью цитохромоксидазы (Цит. оке.) переносятся на кислород. Поток электронов направлен от системы с более низким (более отрицательным потенциалом) к системе с более высоким (более положительным) потенциалом, от — 0,8 — 0,4 в (потенциал субстрата) до + 0,8 в (потенциал кислорода).
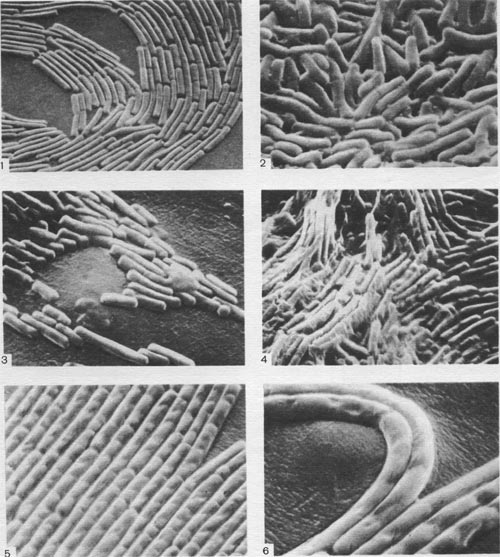
Таблица 37. Расположение клеток в колониях спорообразующих бактерий на поверхности плотных сред: 1—край колонии Bacillus cereus; 2 — центральная часть колонии Вас. cercus; 3 — край колонии Вас. mesentericus; 4 — центральная часть колонии Вас. mesentericus; 5, 6 — тяжи из клеток, образуемые Вас. mycoides. Фотографии сделаны Э. Г. Африкяном в сканирующем электронном микроскопе.
Таким образом, при дыхании конечным акцептором водорода является кислород. У анаэробов в качестве акцепторов водорода выступают либо органические субстраты (брожение), либо неорганические вещества, такие, как нитраты или сульфаты («анаэробное дыхание»). Из схемы видно, что наиболее просто и примитивно транспорт электронов осуществляется у большинства анаэробов из-за отсутствия у них ферментов цепи переноса электронов, способных передавать электроны по цепочке вплоть до молекулярного кислорода.
Молекулярный кислород отрицательно действует на рост и активность облигатных анаэробов. В присутствии свободного кислорода клетки анаэробов теряют подвижность. Благодаря этой реакции анаэробы были впервые обнаружены Пастером. Однажды он рассматривал под микроскопом каплю бродящей жидкости (при маслянокислом брожении), помещенную между двумя тонкими плоскими стеклышками, и заметил, что клетки, находящиеся по краям препарата (куда кислород воздуха . свободно проникал), становились внезапно неподвижными, а палочки, находящиеся в центре препарата (куда воздух не проникал), продолжали очень активно двигаться.
Отсюда Пастер сделал вывод, что кислород воздуха ядовит для некоторых микробов, и разделил последние на две группы — аэробов и анаэробов.
Противники Пастера (например, Трекюль) возражали против утверждения о существовании бактерий, для которых кислород воздуха может быть смертельным, и приводили в пример споры анаэробов, способные длительное время сохраняться на воздухе. На это Пастер отвечал, что споры не являются настоящими живыми существами, так как они не питаются и не размножаются. Последующее развитие науки подтвердило положения Пастера. Так, было показано, что спорам бактерий свойствен крайне выраженный анабиоз и обмен веществ у них находится на таком низком уровне, что его даже не удается измерить с необходимой точностью. В связи с этим споры не чувствительны ко многим повреждающим факторам, а споры анаэробов могут, кроме того (в отличие от вегетативных клеток), легко сохраняться на воздухе.
Вопрос, почему кислород является токсичным для анаэробов, еще недостаточно выяснен. Одни исследователи считают, что токсическое действие кислорода связано с образованием в культурах анаэробных микроорганизмов ядовитых концентраций перекиси водорода, образующейся в результате окисления субстрата кислородом воздуха. Причиной накопления перекиси водорода является отсутствие у анаэробов фермента каталазы (разлагающего перекись). Имеются сообщения, что некоторые штаммы клостридиев могут расти и в аэробных условиях, если к среде добавлена каталаза. Но, с другой стороны, очень важным фактором, определяющим развитие анаэробов, являются окислительно-восстановительные условия среды. Они выражаются через окислительно-восстановительный потенциал (ОВП), измеряемый в вольтах (напряжение на электроде, погруженном в испытуемую среду). Окислительно-восстановительные условия можно выразить также через показатель гНз, характеризующий соотношение между На и 02. rH2 в пределах от 0 до 40 характеризует все степени восстановленности или окисленности среды в зависимости от насыщения ее кислородом либо водородом. Подробные исследования условий развития анаэробов показали, что облигатные анаэробы не могут развиваться при rH2 (или ОВП) выше определенного предела. rНз в среде можно измерить либо электрометрическим способом . (с помощью потенциометров), либо с помощью красителей, которые восстанавливаются и обесцвечиваются (или изменяют цвет) при определенных значениях гНз. Так, например, краситель янусгрюн в аэробных условиях при rH = 20 и выше имеет в растворе зеленый цвет, при rН2 в пределах 12—14 — розовый цвет, а при еще более низких значениях rH он обесцвечивается.
А.Р. Прево проделал следующий опыт (схема 2 на табл. 36). Питательную среду (мясо-пептонный агар или желатин) он наливал в пробирки, кипятил 35 мин и оставлял на воздухе двое суток. Сразу после кипячения среда даже у самой поверхности была сильно восстановленной с низким гН2. Через 48 ч вследствие диффузии кислорода в среду показания гШ сильно изменились. С самой поверхности и до глубины 10 мм гШ составлял 20 единиц (янусгрюн — зеленый). Ниже 10 мм гНа был равен 14 (янусгрюн — розовый). На глубине 13 мм -12,5, при 16 мм — 9,2, а при 17 мм — 8, при 18 мм всего 7,4. Оказалось, что строгие анаэробы могут развиваться в средах с rH не выше 14.
Имеются также виды с высокой степенью анаэробности, которые начинают размножаться лишь при крайне низких значениях rH, приближающихся или почти равных нулю. В области rН2 выше 14 находится зона развития аэробов. В промежуточной области (между аэробиозом и строгим анаэробиозом) могут развиваться микроаэрофильные формы, приспособившиеся к развитию в средах с низкими концентрациями свободного кислорода.
При изучении действия кислорода на раз-. витие облигатных анаэробов было показано, что кислород не оказывает губительного действия на анаэробов, если ОВП среды низкий. Действительно, если к среде добавить восстанавливающие агенты, снижающие ОВП, то некоторые анаэробные микроорганизмы способны развиваться на таких средах в аэробных условиях. В целом анаэробы можно отнести к таким микроорганизмам, рост и развитие которых приурочены к природным субстратам, лишенным свободного кислорода и обладающим низким окислительно-восстановительным потенциалом.
Токсическое действие кислорода воздуха на рост и развитие облигатных анаэробов и тяготение к низкому окислительно-восстановительному потенциалу, по современным представлениям, можно объяснить тем, что молекулярный кислород и высокий ОВП могут служить причиной необратимого окисления жизненно важных ферментов, обусловливающих основные процессы их метаболизма.
Большинство анаэробных спорообразующих бактерий лишено также и других геминовых ферментов. Так, у бактерий из порядков Clostridiales и Plectridiales (по Прево) не обнаружены до настоящего времени цитохромы. Для переноса водорода в ряду субстрат — субстрат ими используются флавиновые ферменты, обладающие свойством аутооксидабильности (самоокисление кислородом воздуха). Хотя ферменты облигатных анаэробов (например, флавиновые) окисляются кислородом, он у них не может служить в качестве физиологического акцептора водорода. Реакция флавиновых ферментов с кислородом направлена на детоксикацию молекулярного кислорода.
Из спорообразующих анаэробов цитохромы (цитохромы бис) обнаружены только у суль-фатредуцирующих микроорганизмов рода De-sulfotomaculum. Эти бактерии также очень чувствительны к кислороду. Таким образом, различия между облигатными анаэробами и аэробами касаются прежде всего ферментативного обеспечения терминального окисления. У анаэробов свободный кислород не может быть использован в качестве конечного акцептора водорода.
В клетках спорообразующих анаэробов в энергетическом обмене веществ играют большую роль флавиновые ферменты.
Не удивительно поэтому, что содержание флавиновых дегидрогеназ в клетках анаэробов (маслянокислые бактерии) значительно выше, чем у аэробов.
Облигатные анаэробы представляют собой, очевидно, пример ранних анаэробных форм жизни. Это согласуется с теорией происхождения жизни на Земле, по которой первичными организмами нашей планеты были анаэробы. Сравнительный биохимический анализ приводит к выводу, что в основе энергетического обмена всех без исключения организмов лежат одни и те же поразительно сходные между собой цепи реакций, не связанных с потреблением свободного кислорода, — реакции, которые происходят в клетках современных анаэробов (по А. И. Опарину).
В связи с этим большое значение имеет также вопрос о локализации в клетках анаэробных микроорганизмов дегидрогеназ. Считалось, что у аэробов дегидрогеназы связаны с мембранами, а у анаэробов, не обладающих цитохрома-ми и окислительным фосфорилированием (кло-стридии), эти ферменты не связаны с мембранами и находятся в цитоплазме только в растворимой форме. Эта точка зрения как будто находится в согласии с данными о том, что ферменты гликолитического цикла (ферменты, участвующие в распаде углеводов в анаэробных условиях) находятся в клетках животных в растворимой форме.
Таким образом создавалось впечатление, что механизмы, обеспечивающие анаэробиоз, в структурном отношении организованы более примитивно. Свидетельством этого является отсутствие в данном случае связи дегидрогеназ с мембранами. Однако недавно было показано, что ферменты гликолитического цикла (в том числе дегидрогеназы) локализуются в плазматической мембране.
Ошибочность прежних данных объяснялась грубостью методов выделения мембран для биохимических анализов. Выделение чистых фракций мембран включает жесткие приемы разрушения клеток и последующее разделение осколков клеток на фракции различных клеточных структур. В процессе таких обработок ферменты, связанные с мембранами, могут легко от них отделиться. Как отмечают известные биохимики Д. Грин и Р. Гольдбергер (1968), именно эта хрупкость мембран вводила в заблуждение два поколения биохимиков, которые считали, что гликолити-ческие ферменты не связаны с мембранами.
Применение электронно-микроскопических методов, позволяющих изучать распределение дегидрогеназ в целых клетках, показывает, что дегидрогеназы у анаэробных спороносных бактерий, очевидно, также связаны с мембранами, играющими у живых организмов огромную роль, особенно в процессах энергетического метаболизма. Например, у такого облигатного анаэроба, как Cl. taeniosporum, активность окислительно-восстановительных ферментов проявлялась только в связи с цитоплазматиче-ской мембраной (рис. 60). В то же время у других анаэробов восстановление акцепторов электронов наблюдается и в цитоплазме. Возможно, эти явления связаны с различным набором ферментов у разных видов либо с неспецифическим восстановлением красителей в цитоплазме.
В качестве индикаторов для окислительно-восстановительных ферментов в электронной микроскопии используют теллурит калия или соли тетразолия. Эти соединения, будучи добавленными в среду и проникая в клетки, акцептируют электроны, которые они получают от дегидрогеназ. В результате реакции эти соединения восстанавливаются и выпадают в осадок, имеющий вид электронно-плотных (темных на экране микроскопа) зернышек, глыбок, тонких слоев. Теллурит в качестве индикатора окислительно-восстановительных ферментов более показателен, чем тетразолии, так как соли тетразолия могут неспецифически восстанавливаться веществами, содержащими сульфгид-рильные группы, а также редуцирующими (восстанавливающими) сахарами. Особенно это относится к анаэробным микроорганизмам, развивающимся при очень низком окислительно-восстановительном потенциале среды и вырабатывающим различные вещества с сильной редуцирующей активностью. Весьма интересно, что у некоторых анаэробных бактерий рода Clostridium обнаружена специфическая, но эффективная форма окислительного фосфорилиро-вания (фосфорилирования в цепи окислительных ферментов).
Если согласиться с утверждением (довольно убедительно обоснованным данными сравнительной физиологии и биохимии) о том, что облигатные анаэробы — это пример ранних форм жизни на Земле, то возникает вопрос, не отразились ли происхождение и эволюция анаэробов на составе и строении их ДНК — хранителе генетической информации. Сейчас уже хорошо известно, что дезоксирибонуклеиновым кислотам всего органического мира присущ единый план строения, а с другой стороны, имеются безграничные возможности вариаций состава и структуры этих соединений. Вполне логично думать, что возникновение ДНК в истории жизни на Земле было весьма важным и, вероятно, даже решающим фактором в дифференциации и обособлении новых групп и видов живых существ. Так как именно нуклеиновые кислоты непосредственно связаны с наследственностью и изменчивостью, то они должны являться материальной основой эволюционного процесса.
Специфичность нуклеиновых кислот для различных организмов обусловливается их химическим строением и может отражаться в первую очередь на количественном соотношении пуриновых и пиримидиновых оснований (на нуклеотидном составе) и на последовательности чередования нуклеотидов в цепи молекулы. Состав ДНК бактерий очень сильно варьирует от самого крайнего АТ-типа (преобладает пара — аденин и тимин) до ГЦ-типа (преобладают гуанин и цитозин). Если выразить соотношение оснований в виде молярных процентов Г + Ц, то колебания этого показателя лежат в пределах от 25 до 75%. Весьма показательно в этом отношении, что сложно организованные прокариотные организмы -актиномицеты — имеют самый высокий процент Г + Ц в ДНК, а примитивные анаэробные спорообразующие бактерии, у которых отсутствуют цитохромы, обладают крайним АТ-типом(до25% Г + Ц).Средиспорообразующих анаэробов также можно выявить определенные закономерности. Так, для гетеротрофных, не содержащих цитохромов бактерий (клостридии) колебания Г + Ц находятся в пределах от 25 до 39%, а для спорообразующих сульфатредуцирующих анаэробов, являющихся хемолито-гетеротрофами и обладающих уже отдельными цитохромами, процент Г + Ц находится в пределах 45—48.
Таким образом, ДНК у анаэробов имеет интересные особенности, и очень многого можно ожидать в будущем от изучения первичной структуры ДНК этих бактерий.
Физиологические группы анаэробных спороносных бактерий
Облигатные анаэробные бактерии, способные образовывать эндогенные споры, в настоящее время можно подразделить в зависимости от характера используемых ими субстратов и особенностей метаболизма на следующие физиологические группы: сахаролитические, протеоли-тические, пуринолитические и сульфатредуцирующие анаэробные бактерии.
Сахаролитические анаэробные бактерии способны сбраживать различные углеводы (органические кислоты и спирты, полисахариды, пектиновые вещества). Обычно конечными продуктами брожений являются органические кислоты, растворители (спирт, ацетон, бутанол и др.), углекислый газ и водород. Было установлено существование нескольких типов брожения.
Маслянокислое брожение осуществляют такие анаэробы, как Cl. butyricum, Cl. tyrobu-tyricum, Cl. lactoacetophilum, и другие виды. Главные продукты брожения — масляная и уксусная кислоты. Так, сбраживание глюкозы Cl. butyricum можно описать уравнением
4 глюкоза —> 2 уксусная кислота + 3 масляная кислота + 8С02+8Н2
Образование масляной кислоты происходит также, если в среду вместо углеводов вносить молочную кислоту вместе с уксусной. Уксусная кислота играет роль акцептора водорода. Образовавшиеся при маслянокислом брожении кислоты далее микроорганизмом не потребляются.
Ацетонобутиловое брожение представляет собой биохимически более сложный тип масля-нокислого брожения, в котором образовавшиеся на первой стадии жирные кислоты превращаются в нейтральные конечные продукты -ацетон, бутиловый и изопропиловый спирты. Если в первой фазе брожения увеличивается кислотность, то во второй фазе кислотность не только не возрастает, но даже уменьшается. Таким образом, за счет превращения кислот в нейтральные продукты регулируется рН среды (кислотность). Ацетонобутиловое брожение углеводов вызывается Cl. acetobutylicum и близкими к нему по физиологии видами.
Cl. butylicum осуществляет брожение, очень сходное по типу с ацетонобутиловым, но отличается тем, что вместо ацетона в этом случае образуется изопропиловый спирт.
Уксуснокислое брожение
Уксуснокислое брожение углеводов наблюдается у Cl. aceticum и Gl. thermoaceticum. Уксусная кислота — единственный продукт брожения.
Пропионовокислое брожение
Пропионовокислое брожение присуще С1. propionicum. В качестве основных продуктов образуются пропионовая и уксусная кислоты, а также углекислый газ.
Брожение пектиновых веществ
Брожение пектиновых веществ (полиурониды) способны осуществлять анаэробные бактерии из различных систематических групп. В настоящее время известно около 18 видов кло-стридиев, способных разрушать пектиновые вещества. Наиболее активные пектинолити-ческие виды — Gl. felsineum, Cl. laniganii, Cl. pectinolyticum, Cl. pectinovorum, Cl. virens и другие пигментированные и непигментированные клостридии и плектридии. Имеются и факультативно-анаэробные формы — Cl. таcerans и Cl. polymyxa. Каждому из этих видов свойственны свои специфические детали обмена веществ, но общим их свойством является способность разлагать пектиновые вещества до органических кислот, спиртов и газов. Некоторые бактерии обладают очень стойкими пектинолитическими свойствами и выделяют пектинолитические ферментш на средах без пектиновых веществ. У других анаэробов (например, у Cl. multifermentans) синтез ферментов происходит только при добавлении в среды пектинов (индуцированный синтез ферментов).
Сбраживание сахаров пектинолитические анаэробы осуществляют по маслянокислому или ацетонобутиловому типу.
Брожение целлюлозы
Большая группа высокоспециализированных анаэробных спорообразующих бактерий получает энергию за счет сбраживания целлюлозы. Конечными продуктами брожения являются уксусная, пропионовая, масляная и молочная кислоты, этиловый спирт, водород и углекислый газ. В качестве промежуточных продуктов при гидролизе целлюлозы образуются глюкоза и целлобиоза. И весьма удивительно, что если добавить к среде глюкозу (или другие сахара), то они очень плохо усваиваются либо совсем не используются. А если в среде имеются одновременно глюкоза и клетчатка, то сбраживается прежде всего клетчатка. Это свидетельствует о высокой специализации целлюлозоразлагаю-щих анаэробов.Целлюлозолитические бактерии отличаются не только физиологическими, но и морфологическими особенностями. Большинство целлюлозолитических спорообразующих анаэробов имеют вид очень тонких длинных палочек, образующих споры по плектридиальному типу.
Обычно вегетативные клетки находятся в адсорбированном состоянии на волокнах целлюлозы (рис. 51). Вероятно, это связано с тем, что ферменты, гидролизующие клетчатку (целлюлазы), в среду не выделяются, а прикреплены к поверхности клеток. Под микроскопом можно увидеть, что разрушаются те участки клетчатки, к которым клетки непосредственно прикасаются. Спорообразующие клетки обычно находятся в растворе, так как при спорообразовании изменяется характер связи со средой, а спорообразование идет за счет эндогенного метаболизма (за счет внутриклеточных запасов питательных веществ).
Первая культура анаэробных спорообразующих бактерий, способная осуществлять брожение целлюлозы, была выделена В. Л. Омелянским. В литературе описано 12 видов целлюлозолитических анаэробов. Спорообразующие Целлюлозолитические анаэробы до настоящего времени очень плохо изучены в связи с трудностями их выделения и культивирования. Большинство выделенных штаммов были загрязнены посторонними бактериями, что значительно обесценивает данные по физиологии и биохимии этих организмов.
Брожение органических кислот и спиртов. Выделено несколько специализированных видов анаэробных бактерий (возможно, их в природе существует намного больше), использующих органические кислоты и спирты в качестве источника углерода и энергии.
Так, Cl. kluyveri получает энергию путем сопряженного окисления-восстановления системы этиловый спирт — уксусная кислота. В результате реакции образуются высшие жирные кислоты (главным образом капроновая и масляная кислоты). Характерно, что Cl. kluyveri не способен сбраживать углеводы, аминокислоты и пурины. Накопление энергии в форме АТФ происходит у этого анаэроба с использованием механизмов окислительного фосфорилирования. Cl. lactoacetophilum осуществляет брожение сходного типа, сбраживая смесь лак-тата и уксусной кислоты. Обе эти бактерии используют в качестве акцепторов водорода уксусную кислоту, а в качестве доноров первая — этанол, вторая — лактат. Cl. glycollicum превращает этиленгликоль в смесь этилового спирта и уксусной кислоты:
Анаэробная бактерия из рода Clostridium (не определенная до вида) осуществляет крайне интересный тип брожения соединений с сульфониевой связью. Такие вещества могут рассматриваться как соединения, обладающие мак-роэргической связью, при разрыве которой выделяется большое количество энергии. Clostridium species (Штадтман, 1968) сбраживает диметилпропиотетин, используя его в качестве единственного источника углерода и энергии:
3(CH3)2S+-CH2CH2COO-+2H20 -> -> 2CH3CH2COO-+CH3COO- + 3(CH8)2S+CO2+H+ пропионовая кислота уксусная кислота диметилсульфид диметилпропиотетин
Протеолитические анаэробные бактерии - очень большая группа анаэробов, получающая энергию за счет анаэробного разрушения аминокислот. Многие из них являются строго протеолитическими организмами, неспособными сбраживать углеводы. Другие обладают слабовыраженной сахаролитической активностью. Имеются также активные протеолитические виды, способные осуществлять маслянокислое брожение Сахаров. Протеолитическая активность у некоторых анаэробов (Cl. histolyticum) настолько высока, что у зараженных этими микроорганизмами животных наблюдается как бы расплавление мышц, после чего остаются голые кости. Освобождающиеся после протео-лиза (разрушение белков протеолитическими ферментами) аминокислоты могут сбраживаться двумя путями. Cl. sporogenes, например, сбраживает пару аминокислот, причем одна из них окисляется, а другая восстанавливается (реакция Стикленда), т. е. одна аминокислота служит донором, а другая — акцептором водорода:
аланин + 2 глицин + 2Н20 -> -> 3 уксусная кислота + C02+3NH3
Существуют виды протеолитических анаэробов, которые могут сбраживать и по одной аминокислоте, например глутаминовую кислоту (Cl. tetani).
Пуринолитические анаэробы
Существуют три вида бактерий, сбраживающих гетероциклические соединения с азотным кольцом: С1. acidiurici, Cl. cylindrosporum и Cl. uracilicum. Они способны разрушать пурины и пиримидины с образованием уксусной кислоты, углекислого газа и аммиака. Первые два вида не способны использовать ни углеводы, ни белки (аминокислоты). Ими быстро расщепляются ксантин, гуанин, гуанозин, 6,8-диоксипурин; более медленно и после адаптации (приспособления) разрушаются гипоксантин и инозин. Cl. acidiurici и G1. cylindrosporum физиологически очень близки, но четко разделяются по морфологическим признакам. У Cl. acidiurici споры имеют овальную форму и расположены терминально. Клетки при спорообразовании раздуваются. У Cl. cylindrosporum споры цилиндрические, расположены центрально или субтерминально. Спорангии при этом не раздуваются.
Сульфатредуцирующие бактерии. Восстановление микроорганизмами полностью или частично окисленных соединений минеральной серы в анаэробных условиях за счет окисления органического вещества или водорода называют микробной сульфатредукцией. Этот процесс был открыт русским химиком Н. Д. Зелинским в 1890—1893 гг. Чистая культура сульфатредуцирующих бактерий была выделена Бейеринком в 1895 г. Сначала бактерий, восстанавливающих сульфаты, относили к неспороносным. Затем было замечено, что в культурах сульфатредуцирующих бактерий иногда появляются споры (когда инкубирование проводилось при высоких температурах). В настоящее время выяснилось, что большинство неспорообразующих штаммов, выделенных из различных субстратов, было загрязнено спо-рообразующими. Последние выделены в новый род Desulfotomaculum, в который входят четыре вида: D. nigrificans, D. ruminis, D. orien-tis, D. antarcticum. Первые два вида используют некоторые органические кислоты (молочную, пировиноградную), но не усваивают углеводы (глюкозу). D. antarcticum способен усваивать глюкозу. D. nigrificans — термофил, оптимальная температура для роста этого вида 55° С. Восстановление сульфатов происходит по уравнению:
2СН3 - CHOH-COOH+Na,S04 -> - 2СН3 - COOH+2C02+H2S+NaOH молочная кислота сульфат натрия уксусная кислота
Таким образом, у анаэробных спорообразующих бактерий мы встречаемся с удивительным физиологическим разнообразием как по механизмам анаэробного получения энергии, так и по диапазону используемых субстратов.
Имеется группа анаэробов, использующих главным образом углеводы; другая группа разлагает преимущественно белки и аминокислоты; третья — сбраживает только пурины; четвертая — получает энергию за счет окисления органических кислот или водорода, используя в качестве акцептора водорода сульфаты.
Специфичность по отношению к субстратам у спорообразующих анаэробов выражена резко.
Потребности в питательных веществах у этих групп весьма различны. Некоторые протеолитические анаэробы (например, Cl. sporogens) не удовлетворяются средами, содержащими полный набор аминокислот, углеводы, минеральные соли, комплекс витаминов, активаторы микробного роста. Такие резко выраженные гетеротрофы растут лишь на средах, содержащих белки или продукты их частичного гидролиза. С другой стороны, существуют анаэробы, развивающиеся на очень простых средах, в состав которых входит несколько минеральных солей, в том числе сульфаты и органическая кислота либо водород в качестве донора электронов (сульфатредуцирующие бактерии). При этом может усваиваться атмосферный азот. Способность фиксировать молекулярный азот широко распространена среди спороносных бактерий. Этот процесс могут осуществлять маслянокислые, ацетонобутиловые и сульфатредуцирующие бактерии. Наиболее активные азотфиксаторы — сахаролитические анаэробы (клостридии).
Отношение к кислороду не одинаковое у различных физиологических групп спорообразующих анаэробов. Более устойчивыми к действию кислорода являются сахаролитические анаэробы. Часть представителей этой группы -аэротолерантные формы (способные давать слабый рост на пластинках агара даже в аэробных условиях), например Cl. carnis, Cl. histolyticum и др. Очень чувствительны к кислороду и трудно культивируются сульфатредуцирующие бактерии. Они могут развиваться только в строго анаэробных условиях при тщательном удалении кислорода из сред, в которых они культивируются.
Распространение и роль в природе спорообразующих анаэробных бактерий
Анаэробные спорообразующие бактерии широко распространены в природе. Их находили в самых различных почвах всех континентов, на скальных породах горных массивов, в морях, пресных водах озер и рек, водах глубинных нефтяных источников, в кишечнике человека и животных и т. д. В определителе А. Р. Прево дано описание около 200 видов анаэробных спорообразующих бактерий. На самом деле их в природе гораздо больше. Общепризнанным является мнение, что только меньшая доля микроорганизмов известна в настоящее время. Особенно это касается анаэробов, которые с большим трудом выделяются из природных субстратов и культивируются в лабораториях. И не случайно с каждым годом мы узнаем о новых микроорганизмах, выделенных «охотниками» за микробами.
С открытием новых, особенно своеобразных, видов и групп микроорганизмов становятся известными новые биохимические процессы, осуществляемые микроорганизмами в природе, новые метаболиты микроорганизмов (ферменты, гормоны, витамины, антибиотики и т. д.), не говоря уже о том, что расширяются наши представления о разнообразии форм микроорганизмов и органического мира в целом. Благодаря очень интенсивному обмену веществ, а следовательно, и необычайно высокой химической активности, микроорганизмы играют огромную роль в круговороте веществ на Земле. Анаэробные микроорганизмы принимают активное участие во многих звеньях этого круговорота, что обусловлено разнообразием и сложностью процессов их обмена веществ, большим набором органических и неорганических веществ, трансформируемых этими микроорганизмами, и крайне широким спектром выделяемых продуктов метаболизма. Во всех биологических циклах (круговороте углерода, азота, серы, фосфора и других элементов) анаэробам принадлежит весьма существенная роль.
Сахаролитические спороносные анаэробы «специализируются» на разложении углеводов и родственных им соединений, попадающих в почву и другие среды благодаря деятельности фотосинтезирующих организмов.
Другие физиологические группы анаэробов участвуют в круговороте азотсодержащих веществ: разлагают белки, аминокислоты, пурины (протеолитические, пуринолитические бактерии). Многие же способны активно фиксировать атмосферный азот, переводя его в органическую форму. Эти анаэробы способствуют повышению плодородия почв. Количество клеток протеолитических и сахаролитических анаэробов в 1 г плодородных почв достигает даже миллионов. Особое значение имеют те группы микроорганизмов, которые участвуют в разложении труднодоступных форм органических соединений, таких, как пектиновые вещества и целлюлоза. Именно эти вещества составляют большую долю растительных остатков и являются главным источником углерода для почвенных микроорганизмов. В анаэробных условиях эти соединения разрушаются пекти-нолитическими и целлюлозолитическими анаэробами.
Деятельность сульфатредуцирующих бактерий очень многогранна. С ними связывают образование нефти, сероводорода в морях, почвах, лечебных грязях. Еще в 1890 г. Н. Д. Зелинский и Е. Брусиловский показали, что слой воды в Черном море, насыщенный сероводородом, является результатом активности сульфатредуцирующих анаэробных бактерий. В почвах деятельность сульфатредуцирующих бактерий приводит к содообразованию. В определенных условиях, благоприятствующих накоплению соды, может произойти содовое засоление почвы. Массовое развитие сульфатредуцирующих бактерий, например, в почвах рисовых плантаций приводит к усилению восстановительных процессов, переводящих многие питательные вещества в доступную для корней риса форму.
Образование сероводорода сульфатредуци-рующими бактериями часто приносит вред, вызывая при определенных обстоятельствах коррозию металлических подводных и подземных сооружений.
Патогенные и токсигенные спорообразующие анаэробы
Некоторые из протеолитических и сахаролитических бактерий могут быть возбудителями болезней, особенно таких, как гангрена и столбняк (так называемые раневые инфекции). Возбудителями газовой гангрены являются такие виды анаэробных спороносных бактерий, как Cl. perfringens, Cl. histolyticum, Cl. septicum, Cl. oedematiens, Cl. bifermentans. Возбудитель столбняка — Cl. tetani. Хотя патогенные бактерии не так часто встречаются в медицинской практике, как другие патогенные микроорганизмы, но вызываемые ими заболевания очень опасны, протекают быстро и часто с фатальным исходом.
Попадая в рану, гангренозные формы анаэробов вызывают быстро распространяющееся разрушение мышечной ткани, сопровождающееся накоплением в ткани водорода. Возбудители вырабатывают сильнодействующие экзотоксины. Наиболее изучен альфа-токсин, выделяемый Cl. perfringens. Это фермент лецитиназа, разрушающая лецитин (важный компонент клеточных мембран). Лецитиназа также лизирует и красные кровяные тельца. Cl. tetani при развитии в ранах продуцирует белковый токсин большой силы, который через кровь и нервные каналы быстро проникает в организм и вызывает повреждение центральной нервной системы.
Cl. botulinum продуцирует токсины, вызывающие опасные, часто фатальные пищевые отравления. Насчитывается 5 разновидностей Cl. botulinum, синтезирующих 6 различных токсинов. Из них наибольшей токсичностью обладает токсин типа Д, 1 мг которого содержит около 1012 минимальных летальных доз для мышей; 5 —10 мг этого токсина способны убить все население земного шара. Это наиболее сильный из всех токсинов, которые способны вырабатывать живые организмы. При пищевых отравлениях чаще всего встречается токсин типа А. Несмотря на большую молекулярную массу (—1000000), токсин легко проникает через стенку кишечника в кровь. Смерть обычно наступает в результате остановки дыхания. Токсин очень устойчив к действию протеолитических ферментов кишечного тракта, но термолабилен и может разрушаться при кипячении.
Использование анаэробов в промышленности
Получение ацетона и бутанола с помощью микроорганизмов было первым крупнотоннажным производством, где нашли применение анаэробные спорообразующие бактерии. В качестве продуцента ацетона и бутанола использовался Clostridium acetobutylicum, вызывающий ацетонобутиловое брожение углеводов.
Ацетон и бутанол — ценное сырье для производства взрывчатых веществ и каучука. Бутиловый спирт — один из лучших растворителей целлюлозных лаков. Особенно широко начал применяться микробиологический способ получения растворителей в конце 40-х годов. В последние годы расширяется использование микроорганизмов как в нашей стране, так и за рубежом для промышленного производства таких ценных веществ, как антибиотики, ферменты, аминокислоты, гормоны, витамины, белкововитаминные препараты.
Дальнейший прогресс микробиологической промышленности связан с поисками и внедрением новых перспективных продуцентов веществ, необходимых для народного хозяйства. В этом отношении экономически выгодно может быть применение анаэробных микроорганизмов, в частности спорообразующих анаэробов, которые, как известно, являются активными продуцентами ряда важных ферментов: пектиназ, цел-люлаз, протеаз, липаз, амилаз, декарбоксилазы и гиалуронидазы. Анаэробы в некоторых странах уже используются для трансформации стероидных гормонов, а также для получения липазы, коллагеназы и пектаз. Так как при выращивании анаэробов воздух (кислород) в ферментеры подавать не нужно, производственный процесс облегчается, а стоимость продуктов ферментации значительно удешевляется по сравнению с аналогичными аэробными процессами.
В последнее время показано, что споры некоторых видов анаэробов при внутривенном введении животным проявляют онколитическую активность (наблюдается разрушение злокачественных образований). Споры анаэробов обладают также радиопротекторной активностью и при внутривенном введении животным способны повышать выживаемость и среднюю продолжительность жизни животных, облученных смертельной дозой радиации. Очевидно, споры анаэробов можно использовать для получения онколитических и радиопротекторных веществ.
Спороносные анаэробные бактерии применяются при мочке льна, конопли и других лубоволокнистых растений. Под влиянием микробных ферментов (пектиназ) расщепляются пектиновые вещества, склеивающие паренхим-ные клетки и лубяные пучки между собой. Этот процесс используется для получения волокна, необходимого для текстильной промышленности. До сих пор в промышленных условиях мочку льна осуществляют без регулирования состава пектинолитических микроорганизмов. В то же время применение в виде заквасок чистых культур анаэробов (активных пектинолитических клостридиев) сокращает процесс в 3—4 раза и позволяет получать волокно высокого качества. Применение специальных препаратов позволит в будущем, кроме того, стандартизовать процесс получения льняного волокна. Пектинолитические ферменты анаэробов имеют в этом отношении преимущество по сравнению с ферментами грибов, которые содержат примеси целлюлаз, ухудшающих качество волокна.
Дальнейшее всестороннее изучение обширного мира анаэробных бактерий не только приведет ко многим важным открытиям теоретического характера, но и будет способствовать широкому практическому использованию деятельности анаэробных микроорганизмов в народном хозяйстве.
Таблица 38. Нитевидные формы анаэробных бактерий, растущих на почвенных частицах (фото В. И. Дуды).
Таблица 39. Спорангии и споры у актиномицетов.
Систематика спорообразующих анаэробных бактерий
В настоящее время имеются три наиболее известные системы классификации анаэробов: Н. А. Красильникова (1949), Берги (1957) и Прево (1957, 1967). По Красильникову, все спорообразующие бактерии объединяются в семейство ВасШасеае. Это семейство имеет два рода — Bacillus и Clostridium. В род Bacillus входят как аэробные, так и анаэробные бактерии (последние составляют Х-группу), которые не образуют гранулезы и не раздуваются (либо слабо раздуваются) при спорообразовании. Род Clostridium объединяет бактерии, клетки которых в процессе спорообразования раздуваются с приобретением клостридиальной (лимоновидной) формы и накапливают гранулезу.
За прошедшие 20 лет после издания определителя Красильникова накопилось много данных об анаэробных микроорганизмах, их видовом разнообразии, биохимии, физиологии и цитологии. Были обнаружены новые физиологические группы, относящиеся к разным родам, и выделено много новых видов спорообразующих анаэробов.
Определитель Прево, Турпина и Кайзера наиболее полно описывает анаэробные микроорганизмы, известные в настоящее время микробиологам. Около 200 видов спорообразующих анаэробных бактерий распределяются в нем по трем порядкам: Clostridiales, Plectridiales и Sporovibrionales (схема 3 на табл. 36).
Морфологические различия между вегетативными клетками различных видов очень незначительны, а спорулирующие клетки и сами споры необычайно разнообразны. Это явление имеет очень большое значение для разделения анаэробов на систематические группы. Для разделения на порядки служит форма вегетативных клеток (прямые или изогнутые палочки) и расположение спор в спорангиях (центральное, субтерминальное и терминальное). При разделении на семейства и роды принимаются во внимание грамокраска, подвижность клеток, способность образовывать капсулу. Различные сочетания этих признаков позволили разделить все спорообразующие анаэробные бактерии на 5 семейств и 10 родов.
Порядок Clostridiales. К нему относятся подвижные и неподвижные грамположительные и грамотрицательные палочки, раздувающиеся при спорообразовании. Споры расположены центрально и субтерминально. Имеются пигментированные виды. В основном анаэробные, но возможны факультативные формы. В порядок входят два семейства.
Семейство Endosporaceae включает грамотрицательные клостридии; споры расположены центрально или субтерминально. В этом семействе два рода: Endosporus — подвижные формы и Paraplectrum — неподвижные, образуют капсулу. Семейство Clostridiaceae включает грамположительные клостридии. Споры центральные или субтерминальные. Подразделяется на три рода: Inflabilis — неподвижные формы, Welchia — неподвижные капсулированные палочки, Clostridium — подвижные формы.
Порядок Plectridiales. Подвижные и неподвижные, грамположительные и грамотрицательные палочки. Споры образуются терминально. Порядок подразделяется на два семейства.
Семейство Terminosporaceae — грамотрицательные плектридии. Семейство состоит из двух родов: Terminosporus — подвижные и Cadu-ceus — неподвижные формы.
Семейство Plectridiaceae — грамположительные плектридии. В этом семействе два рода: Plectridium — подвижные и Acuformis — неподвижные организмы.
Порядок Sporovibrionales включает спорообразующие подвижные анаэробные бактерии с изогнутыми (вибрионоподобными) грамотрицательными клетками. Большинство из них способно восстанавливать сульфаты и нитраты.
В этом порядке одно семейство — Sporovibrionaceae. В него входит один род — Sporovibrio, объединяющий четыре вида спорообразующих анаэробов. Один из этих видов — Sporovibrio ferrooxydans — не восстанавливает сульфатов, а железо окисляет в гидрат железа. По Кэмпбеллу и Постгейту, все спорообразующие анаэробы, обладающие постоянной способностью восстанавливать сульфаты, были выделены в новый род — Desulfo-tomaculum. В него входят облигатные анаэробы с грамотрицательными, прямыми или изогнутыми палочками, раздувающимися у термофильных форм. Споры формируются терминально или субтерминально. Бактерии подвижные, жгутикование перитрихиальное, восстанавливают сульфаты до сульфидов. Обладают цито-хромами (класс протогеминов). Состав ДНК колеблется в пределах 41,7—49,2 мол.% Г+Ц.
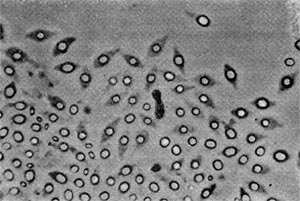
Рис. 64. Сульфатредуцирующая спороносная бактерия. Клетки при спорообразовании раздуваются. Увел. Х2700.
Неспоровые сульфатредуцирующие бактерии из рода Desulfovibrio четко отличаются от спорообразующих по проценту Г + Ц в ДНК, наличию пигмента десульфовиридина и цито-хрома, монотрихиальным жгутикованием и отсутствием спорообразования.
Род Desulfotomaculum включает четыре вида. D. nigrifleans — типовой вид. Споры овоидные, субтерминальные. Бактерии могут расти без сульфатов на среде с пируватом. Глюкозу и другие углеводы не используют, термофильные. Температурный оптимум 55° С. Процент Г + Ц в ДНК 49,2. D. ruminis. Споры овоидные, терминальные или субтерминальные. Бактерии способны расти без сульфатов на среде с пируватом. Глюкозу и другие углеводы не сбраживают, мезофилы, Г + Ц в ДНК-49,2%.
D. orientis. Споры круглые, могут располагаться в клетках центрально, эксцентрально и терминально. Глюкозу и другие углеводы бактерии не сбраживают, не растут на средах с пируватом без сульфатов, мезофилы. Процент Г+Ц в ДНК 45,1. Японские авторы описали еще один вид спорообразующих сульфатредуцирующих бактерий — D. antarcticum. Споры этих бактерий овоидные, располагаются в клетках центрально или терминально. Нуклеотидный состав ДНК неизвестен. Этот вид отличается от других видов рода Desulfotomaculum способностью использовать глюкозу и разжижать желатин.
Аэробные спрообразующие бактерии. Род бациллюс (BACILLUS)
Аэробные спорообразующие бактерии составляют довольно обширную группу микроорганизмов. Они широко распространены в природе и играют большую роль в разнообразных биологических процессах. С использованием этих бактерий в промышленности освоено производство ценных ферментов, антибиотиков, органических кислот и других соединений.
Среди этой группы бактерий имеются и патогенные для человека и животных формы. В этом отношении особенно тщательно изучен сибиреязвенный бацилл. Имеются данные о фитопатогенных свойствах отдельных видов спорообразующих бактерий, обусловливающих развитие гнили и других поражений у растений.
Некоторые виды спорообразующих бактерий являются возбудителями болезней полезных насекомых. Образуя единственные в своем роде покоящиеся формы организмов — споры, эти бактерии служат объектом многочисленных исследований для выяснения природы ана- и парабио-тического состояния живой материи. С другой стороны, благодаря образованию спор, обладающих среди известных форм живых организмов наиболее высокой устойчивостью к неблагоприятным воздействиям внешней среды, спорообразующие бактерии представляют собой основной фактор биологического разрушения пищевых продуктов и различных других материалов.
Борьба со спорообразующими бактериями является одной из главных практических задач в консервной промышленности, при консервации крови и многих других процессах хранения и переработки сельскохозяйственных и пищевых продуктов.
Спорообразующие бактерии распространены повсеместно — в воздухе, водоемах, на растительных и животных остатках и других естественных субстратах.
Благодаря способности образовывать споры, обладающие большой устойчивостью к внешним воздействиям, спорообразующие бактерии остаются жизнеспособными при самых неблагоприятных условиях. Эти формы микроорганизмов выдерживают резкие колебания температуры, отсутствие влаги и воздуха, действие различных химических соединений, обычно губительно влияющих на живые организмы. Поэтому среди бесчисленного множества самых различных форм микроорганизмов спорообразующие бактерии являются наиболее устойчивыми и приспособленными к изменениям среды. Часто при анализе разных субстратов, подвергшихся неблагоприятным воздействиям, единственными представителями микробов бывают зародыши спороносных бактерий — споры.
Таким образом, спороносные бактерии имеют по сравнению с другими формами микробов большие возможности приспосабливаться к тем или другим условиям среды.
Спорообразующие бактерии распространены в морях и океанах, включая их глубокие слои и арктические воды. Работами А. Е. К рисса, С. И. Кузнецова и других советских ученых установлено распространение разнообразных видов спорообразующих бактерий в водоемах и их участие во многих биологических процессах среды своего обитания.
Большинство видов спорообразующих бактерий, подобно другим микроорганизмам, в основном обитает в почве. Однако не все почвы богаты спороносными бактериями. Содержание их в одной и той же почве различно в зависимости от окультуренности почвы, метеорологических, сезонных изменений и многих других факторов.
Почвы разных типов или возраста содержат неодинаковое число спорообразующих бактерий. Значительная часть таких бактерий обитает в бурых, сероземных, пустынных почвах, характеризующихся малым содержанием органического вещества. В богатых перегноем почвах спорообразующих бактерий сравнительно мало, например в арктических, дерново-подзолистых, лесных и горнолуговых.
Наряду с изменениями в общем (валовом) содержании спорообразующих бактерий особенно большие различия отмечаются в их видовом составе. В одних типах почв преобладают одни виды, в других — другие.
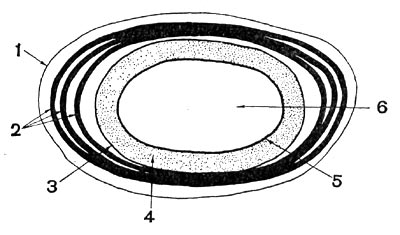
Рис. 65. Схематическое изображение строения споры: 1 — экзоспориум; 2 — слои споровой оболочки; 3 — внешняя мембрана споры; 4 — кора; 5 — внутренняя мембрана споры; 6 — сердцевина.
Фундаментальными работами в области экологии аэробных спорообразующих бактерий явились исследования Е. Н. Мишустина и его сотрудников. Были выявлены определенные закономерности распространения в почве отдельных видов спороносных бактерий. Так, установлено, что в биологических процессах, протекающих в почве, неспороносные бактерии связаны с превращениями гумуса на первых стадиях его минерализации, и поэтому по соотношению числа спороносных и неспороносных бактерий можно судить об интенсивности минерализации органического вещества в почве. Были выявлены характерные группировки спорообразующих бактерий, свойственные определенным почвенным типам и эколого-геогра-фическим зонам. На основе этих работ развились представления о показательных свойствах спорообразующих бактерий, отражающих почвообразовательный процесс, и описаны доминантные и типичные группы этих организмов для отдельных почвенно-климатических зон.
Закономерности эколого-географического распространения в почве различных видов споро-образующих бактерий достаточно рельефно обнаруживаются и по вертикальной зональности — при обследовании горных районов с большим разнообразием типов почвы, растительных формаций и климатических условий. С увеличением высоты в горах содержание и состав бактерий претерпевают закономерные изменения, в общем подобные тем, которые отмечаются при обследовании разных типов почв по широтной зональности.
Таким образом, изучение эколого-географического распространения спорообразующих бактерий выявляет специфику микробного населения различных типов почв и подтверждает учение В. В. Докучаева о зонах природы, горизонтальной и вертикальной зональности почвенного покрова. Общее количество и видовой состав споро-образующих бактерий в почве подвержены большим изменениям в зависимости от ее влажности и температуры.
При повышении влажности почвы после обильного дождя отмечается интенсивное размножение неспороносных бактерий. Их массовое развитие приводит к угнетению роста и развития спороносных бактерий. Их количество в почве может уменьшиться. Такое явление наблюдается при влажности почвы в пределах 50—60% и более от полной влаго-емкости. При умеренной влажности, в особенности в несколько подсохшей почве, количество спороносных бактерий увеличивается, а число неспороносных бактерий значительно уменьшается.
Много разнообразных спорообразующих бактерий обнаруживается в почвах со сравнительно высоким температурным режимом. Обильны бактериями почвы южных районов, а на севере и в почвах полярного круга их сравнительно мало. Значительный перегрев почвы на юге губительно действует на неспороносные бактерии, в то время как споровые формы переносят его хорошо.
У хорошо известного вида спорообразующих бактерий — Вас. mycoides установлено наличие эколого-географических разновидностей, характерных для отдельных почвенно-климатиче-ских зон. Выявлено, что у культур этих бактерий с удалением от севера к югу положение оптимальной и максимальной температур развития соответственно повышается. Южные культуры бактерий интенсивнее размножаются и обладают гораздо более высоким осмотическим давлением в клетках, нежели северные. У других видов спороносных бактерий такой приспособительной реакции к температурным условиям среды не отмечено.
Своеобразие эколого-географических условий приводит к расселению отдельных видов и разновидностей спорообразующих бактерий в определенных типах почв. Так, установлено очаговое распространение в красноземах неестественных, правозавитых, или так называемых инверсивных, форм Вас. mycoides. В солончаках обнаружены особые, галофильные разновидности спорообразующих бактерий, приспособившиеся к жизни в среде с высокой концентрацией солей. На питательных средах с небольшими концентрациями минеральных солей эти культуры развиваются очень слабо. Растительный покров оказывает значительное влияние на количественный и качественный состав спорообразующих бактерий в почве.
В почве, непосредственно прилегающей к корням растений (ризосфера), основная масса микробов представлена неспороносными бактериями. Споровых форм здесь очень мало. Однако на разлагающихся растительных остатках, которых много в почве осенью, спорооб-разующие бактерии обнаруживаются в значительном количестве.
Многие виды спорообразующих бактерий активно продуцируют ферменты, разлагающие обычно трудно разрушающиеся растительные остатки. Благодаря деятельности микроорганизмов почва обогащается ценными питательными веществами и освобождается от многих вредных организмов и продуктов. Возделывание в течение ряда лет одной и той же культуры может значительно изменить качественный состав спорообразующих бактерий в почве. Сдвиги в видовом составе споровых бактерий отмечаются при многолетнем культивировании люцерны и хлопчатника. В севооборотах эти различия несколько стираются, однако для микробиологических исследований как споровых, так и других форм бактерий в разных почвах знание истории поля обязательно. Накопление в почве спорообразующих бактерий-антагонистов оказывает благотворное действие на ее оздоровление, приводя к снижению в почве количества болезнетворных микробов.
Установлена ведущая роль спороносных бактерий в более глубоких стадиях распада веществ в компостах и других органических, соединений почвы. Обработка почв и агрохимические мероприятия, приводящие к уменьшению содержания подвижного органического вещества в почве, сопровождаются повышением содержания бациллярной флоры. Подобное явление отмечается и при длительном использовании минеральных удобрений. Количество спорообразующих бактерий повышается в нижних слоях почвы.
Сравнительно высокое содержание в почве спор бактерий является отражением определенной стадии в развитии этих организмов и не может свидетельствовать о неактивности спороносных бактерий.
О спорах бактерий, их химическом составе и структуре, процессах образования и прорастания подробно было рассказано в предыдущей главе. Здесь же мы остановимся на отличительных чертах, характерных для аэробных спорообразующих бактерий.
Поверхность наружной оболочки спор разнообразна у аэробных бактерий: либо гладкая, либо с выростами, выступами и почками. Оболочка составляет значительную часть споры. Основными ее компонентами являются белки (60—90%) и липиды. Состав аминокислот в белках оболочки неодинаков у бактериальных спор разных видов, однако большая часть цистина, содержащегося в значительном количестве в спорах, обнаруживается именно в оболочке.
Под оболочкой располагается кора споры (рис. 65), состоящая в основном из муреина. который является нерастворимым структурным материалом коры.
В течение многих лет покоящаяся спора рассматривалась как почти инертное тело, обладающее несколькими ферментами или вовсе лишенное их. Некоторых ферментных систем, имеющихся в вегетативной клетке, например цитохромов и ферментов цикла трикарбоновых кислот, ничтожно мало в споре. Это указывает на то, что в спорах аэробный энергетический метаболизм осуществляется иным путем, чем в клетках. Аналогичные ферменты спор и вегетативных клеток в спорах более термоустойчивы.
Споры аэробных бактерий обладают различной термоустойчивостью, что обусловлено как видовыми особенностями, так и условиями их образования. Установлено, что споры, образующиеся при высокой температуре, а также полученные на средах с высоким содержанием кальция, парааминобензойной кислоты и некоторых жирных кислот, более жароустойчивы.
Споры более устойчивы, чем вегетативные клетки, от которых они образовались, к воздействию проникающей радиации, ультразвука, гидростатического давления, замораживания, разрежения и др. Устойчивость спор к кислотам и щелочам во многом зависит от их принадлежности к различным видам бактерий. Споры некоторых культур бактерий остаются жизнеспособными даже при кипячении в концентрированной соляной кислоте в течение 20 мин. При этом резистентность спор во много раз повышается при их обезвоживании.
К спиртам и другим органическим растворителям устойчивость спор намного выше, чем у вегетативных клеток. Споры менее устойчивы к действию алкилирующих агентов. При воздействии комплекса определенных ферментов удается достигнуть растворения спор.
Механизм устойчивости спор к действию высокой температуры, проникающей радиации и других физико-химических факторов полностью еще не выяснен. Термоустойчивость спор объясняется наличием кальция, дипиколиновой кислоты и в некоторой степени диаминопимелиновой кислоты. Эти вещества определяют в значительной мере и резистентность спор к действию радиации. Полагают, что споры содержат комплекс особых веществ, подобных хелатным соединениям, которые предохраняют жизненно важные структурные элементы от губительного воздействия физико-химических факторов. Важным фактором, приводящим к образованию спор, является отсутствие для данного вида аэробных бактерий благоприятных условий для роста и развития. Способствует спорообразованию обеднение питательной среды.
У аэробных бактерий анаэробные условия выращивания подавляют как спорообразование, так и рост. Спорообразование аэробных бактерий протекает лишь в условиях доступа кислорода. Интенсивность споруляции подавляется в разной степени при выращивании бактерий в неблагоприятных условиях — при температуре выше оптимальной или реакции среды менее подходящей для обильного развития. Неблагоприятные условия роста, ускоряющие споруляцию бактерий, как правило, не обусловливают обильного «урожая» спор.
Разные виды аэробных бактерий отличаются расположением и формой спор. Эти признаки имеют важное систематическое значение. У некоторых видов расположение спор строго определенное — центральное, околоконцевое и концевое. У других видов не наблюдается строгой локализации. Высокое содержание в питательной среде источников азотного и углеродного питания, обеспечивающих максимальный рост бактерий, может подавлять индукцию спорообразования. Так, потребность в глюкозе — основном энергетическом источнике вегетативного роста аэробных бактерий — является несущественной для спорообразования некоторых видов, а в отдельных случаях она угнетает процесс споруляции. Культуры определенных видов бактерий более интенсивно спорулируют при уменьшении в среде аланина, валина, лейцина и изо-лейцина. У других бактерий отсутствие в среде лейцина и серусодержащих аминокислот угнетает спорообразование.
Интенсивность процесса образования спор в значительной мере обусловлена наличием в среде минеральных солей, содержащих ионы кальция, магния, калия, марганца, железа, цинка, меди и некоторых редких металлов (кобальта, лития, кадмия, никеля). Оптимальная концентрация минеральных солей и металлов различна в зависимости от вида выращиваемой культуры бактерий, условий ее роста. Роль минеральных солей и отдельных ионов металлов настолько велика, что в их отсутствии спороношение может вовсе не наблюдаться. Изменения концентраций их в питательной среде могут оказать иногда резко различное действие.
Спорообразование отдельных культур бактерий настолько зависит от наличия минимальных концентраций некоторых металлов, что эта особенность используется в аналитических целях.
Роль минеральных солей различных металлов в образовании бактериальных спор установлена недавно, и многие вопросы механизма их действия пока не выяснены. Полагают, что их специфическое действие связано с активированием различных ферментативных систем. Значение таких элементов, как кальций, заключается также и в том, что они способствуют образованию разнообразных низкомолекулярных веществ в спорах, обеспечивающих их термостабильность.
Сравнительно слабо изучено влияние на образование спор различных витаминов и других ростовых веществ. Некоторое усиление этих процессов отмечено под влиянием параамино-бензойной и фолиевой кислот.
В результате всестороннего изучения биохимии спорообразования показано, что при спору-ляции не образуются новые ферментные системы. Аналогичные ферменты, обнаруживаемые в вегетативной клетке и споре, имеют одинаковые молекулярный вес, аминокислотный состав и другие физико-химические свойства. Теплоустойчивость ферментов спор вызвана присутствием в них ионов кальция, марганца и других металлов. Данные исследований свидетельствуют о том, что природа и функция ферментативного аппарата, осуществляющего синтез белков в споре и материнской вегетативной клетке, одинаковы. Основной системой транспорта электронов в спорах является растворимая флавопротеино-ксидаза. При споруляции выявлена высокая активность ряда ферментов, например аргиназы, некоторых нуклеаз. Основная масса белков споры синтезируется заново в период споруляции. Одновременно отмечается процесс распада белков, причем многими авторами обнаружена тесная взаимосвязь протеолитической активности с функцией спорообразования у бактерий. Из вновь синтезированных белков лишь незначительная часть используется для создания структурных элементов споры. В целом споруляцию можно охарактеризовать как процесс интенсивного распада белков и всех основных типов РНК материнской клетки с одновременным образованием новых белковых компонентов.
Различия в составе белков споры и вегетативной клетки выявляются серологическими методами. По антигенной структуре спорулирующая и аспорогенная формы культур одного и того же вида различны. Не установлено существование какого-либо антигена, общего для спор бактерий разных видов. Наоборот, по антигенной структуре имеется достаточно отчетливая дифференциация между спорами разных видов.
В способе прорастания споры и продолжительности процесса также отмечается определенное постоянство, характерное для различных видов бактерий. Старые споры прорастают в течение более длительного периода, чем молодые. Время прорастания молодых спор является довольно постоянным у различных бактерий и может служить видовым признаком. Если перенести только что сформировавшиеся споры в благоприятную питательную среду, то прорастание их начинается не сразу, а по истечении 2—3 ч.
Установлено, что на начальной стадии прорастания спор происходит выделение в среду так называемого экссудата прорастания, характеризующегося специфическим поглощением ультрафиолетовых лучей. Вещество это было выделено и идентифицировано как кальциевая соль дипиколиновой кислоты (пиридин — 2,6-дикарбоксиловая кислота). Дипиколинат кальция составляет приблизительно половину сухой массы экссудата прорастания, что соответствует 15% от общей сухой массы покоящихся спор. Остальная часть экссудата прорастания представлена свободными аминокислотами, высокомолекулярными и низкомолекулярными белковыми веществами. Обнаружено особенно большое количество недиализируемого гексозаминсодержащего пептида с молекулярным весом порядка 10 000, в состав которого входят диаминопимелиновая кислота, аланин, глюта-миновая кислота и гексозамины. Условно это соединение названо ДАП-гексозаминпептид. Это соединение входит в состав оболочки спор, в отличие от дипиколиновой кислоты, обнаруживаемой внутри спор.
Среди факторов, способствующих процессу прорастания спор, большое внимание уделяется тепловой активации, действие которой более выражено при наличии в среде некоторых химических соединений. Тепловая активация достигается предварительным кипячением суспензии спор при 97—100° С в течение 10—15 мин или при 65° С в течение 2 ч. Иногда этот эффект достигается при обычной пастеризации. Тепловая активация прорастания спор носит общий характер для разных видов спороносных бактерий, хотя она более специфична для аэробов, чем анаэробных видов. Обычно тепловое воздействие усиливает и ускоряет прорастание спор в течение короткого промежутка времени. Действие подобной обработки спор, как правило, преходяще, хотя при этом отмечается и некоторое изменение условий, необходимых для течения процесса прорастания спор. Так, для лучшего прорастания спор сенного бацилла без предварительной тепловой обработки необходимо присутствие в среде L-аланина, аденозина, глюкозы и тирозина, тогда как после тепловой обработки оптимальные условия прорастания спор обеспечивают наличие лишь глюкозы и аденозина. Установлено также, что сохранение в течение длительного времени спор при 37° С после их тепловой активации ведет к деактивации. Тепловая обработка этих спор после длительного хранения вновь ведет к реактивации прорастания.
Имеются данные о некотором активирующем влиянии на прорастание спор умеренного воздействия ультразвука. Исследования последних лет показали, что интенсивность прорастания спор специфически повышается в присутствии некоторых веществ, в первую очередь L-аланина, пуриновых нуклеозидов и глюкозы. Иногда необходимо наличие, помимо L-аланина, ряда других аминокислот. Из рибозидов наиболее эффективным оказался аденозин.
Алании является наиболее специфическим активатором процесса прорастания спор из всех известных соединений, обладающих подобным действием. Оптимальные условия для прорастания спор анаэробных бактерий несколько более сложны, хотя факторы, активирующие процессы прорастания спор аэробных видов, и в этом случае оказывают активирующее действие.
Наряду с активаторами выявлен ряд веществ, угнетающих процесс прорастания спор. Прорастание спор у аэробных видов угнетается в присутствии оксина, некоторых мышьяковистых соединений, углекислого натрия, высоких концентраций ряда аминокислот — глицина, метионина, цистеина и валина. Характерно угнетающее действие D-аланина в отличие от L-аланина.
Механизм активирующего и угнетающего действия ряда факторов на прорастание спор остается неясным. Одни авторы приписывают активаторам определенную роль в процессах деполимеризации различных составных элементов в спорах, высвобождении и активации ряда ферментных систем, обусловливающих начало прорастания спор. Другие считают их энергетически активными соединениями, стимулирующими биохимические процессы в момент прорастания спор.
Обычно не все споры, вносимые в благоприятную среду, прорастают сразу. Некоторое их количество остается непроросшими в течение различного времени, не теряя, однако, своей жизнеспособности. Установлено, что при длительном хранении процент прорастающих спор постепенно снижается. Причина этого явления и природа подобных «дремлющих» спор остаются неясными.
В покоящейся споре имеются ферментные системы, выявляемые лишь после их активации под влиянием определенных факторов и химических соединений, которые, однако, исключают прорастание спор. К таким системам относятся прежде всего окислительные ферменты.
Активация их достигается обработкой спор незначительными количествами L-аланина, аденозина и некоторыми другими веществами, а также кипячением или пастеризацией суспензий спор. Перевод неактивной ферментной системы в активную без признаков прорастания спор считается первым этапом биохимических изменений в спорах, ведущих в дальнейшем к началу процесса их прорастания. Полагают, что под действием активаторов дипиколиновая кислота, связывающая окислительные и другие ферменты, подвергается деполимеризации с освобождением ферментных систем.
С помощью высокочувствительного микрореспирометра у бактериальных спор установлена дыхательная активность.
При изучении химического состава клеточной стенки спор различных видов аэробных бактерий обнаружены характерные различия в содержании ДАП-гексозаминпептида и других веществ — полисахаридов, липидов. ДАП-гек-созаминпептид высвобождается из стенки спор под действием литического агента, уподобляемого по своим свойствам лизоциму.
Классификация аэробных спорообразующих бактерий
По современным представлениям, аэробные спорообразующие бактерии, или бациллы, объединяются в отдельный род Bacillus семейства Bacillaceae. Этот род, включающий много разнообразных видов, имеет ряд характерных особенностей и отличается от других бактериальных организмов комплексом морфолого-физио-логических признаков, из которых наиболее важными являются палочковидная форма клеток, способность образовывать эндоспоры, потребность в свободном кислороде для роста.
Общая краткая характеристика объединяемых в род бацилл аэробных спорообразующих бактерий сводится к следующему.
Бациллы — свободноживущие, одноклеточные, нефотосинтезирующие, аэробные, палочковидные клетки, образующие типичные эндоспоры. Относятся к гетеротрофным организмам. Размножаются поперечным делением клеток. Ветвление и почкование клеток как способ размножения не отмечены. Поперечный размер клеток варьирует в пределах 0,4—2 мкм. Вегетативные клетки имеют вид прямых или слабоизогнутых палочек с параллельными сторонами и округлыми концами, которые в редких случаях резко обрезанные.
Расположение клеток различное — от одиночных до длинных цепочек. За исключением сибиреязвенного бацилла, бактерии этого рода подвижные, снабжены перитрихиально расположенными жгутиками.
Большинство видов является грамположительными бактериями, часть — грамвариабильными. Клетки хорошо окрашиваются обычными анилиновыми красками. Ни один представитель рода не является типично кислотоустойчивым организмом. У многих видов отмечается наличие внутриклеточного жира, гликогена, волю-тина и других включений. Капсула встречается лишь у сибиреязвенного бацилла и некоторых других видов при специфических условиях роста.
В бактериальных клетках в общем количестве оснований ДНК 32—65 мол.% гуанина и цитозина.
Большинство видов, исключая некоторые, главным образом энтомопатогенные, формы, хорошо растет на мясопептонном агаре (МПА) при реакции среды, близкой к нейтральной. Отдельные виды развиваются в щелочной среде и требуют особых источников азота или углерода.
Культуральные особенности видов, выросших на разных средах, резко различны. На твердых питательных средах образуются колонии от 1—2 до 5 мм и более в диаметре: гладкие, зернистые, пленчатые, складчато-морщинистые и сухие, слизеобразующие и пастообразные с характерной структурой края. При развитии на жидких средах обнаруживается тенденция к образованию поверхностной пленки. Встречаются виды, образующие на поверхности агаризованных сред подвижные колонии.
Большинство видов бактерий активно продуцируют ферменты, гидролизующие белки, крахмал и другие субстраты. Многие виды обладают антагонистическими свойствами и вырабатывают антибиотики полипептидной природы. Отдельные виды нуждаются в присутствии витаминов, аминокислот и других дополнительных факторов роста. Кислоту и газ продуцируют лишь бактерии некоторых видов, все остальные при росте на углеводах образуют одну кислоту. Оптимальная температура роста обычно варьирует в пределах 30—40° С. Встречаются виды, развивающиеся при температуре ниже 12° С и выше 50° С.
Некоторые аэробные бактерии — возбудители болезней. Вас. anthracis вызывает сибирскую язву у человека и животных; Вас. larvae — возбудитель американского гнильца медоносной пчелы; Вас. alvei и Вас. pulvifaciens трактуются как организмы, играющие определенную роль в болезнях пчел; Вас. popilliae и Вас. lentimorbus — возбудители молочной болезни японского жука; некоторые виды группы Вас. cereus-thuringiensis вырабатывают специфические энтомоцидные токсины.
Классификация видов аэробных спорообразующих бактерий разработана недостаточно полно. Одной из причин этого является ограниченность различий во внешних признаках бактерий. Известно, что большинство видов различаются между собой малозначимыми признаками строения и развития клеток, по форме колоний, а также физиологическим признакам. Многие вопросы биологии спороносных бактерий требуют глубоких исследований. Хорошо изучены только те виды, которые имеют практическое значение (патогенные, бродильные формы, продуценты различных антибиотиков, ферментов и т. д.). Вопросы систематики спорообразующих бактерий изучались специалистами прикладных наук для диагностических целей, в основном санитарно-гигиенического назначения.
Для выделения бактерий в самостоятельные виды одни авторы считают решающими ферментативные свойства организмов, другие — морфологические и культуральные признаки, третьи — цитологические особенности бактериальной клетки и т. д. Во всех подобных случаях принципы систематики меняются по мере выявления новых особенностей в строении и физиологических свойствах организмов и использования их в качестве признаков видовой идентификации. Систематика разных видов спорообразующих бактерий отражает степень их изученности, а следовательно, должна развиваться и изменяться по мере накопления новых данных.
Вопросы систематики бактерий представляют исключительную важность для работ по изысканию и изучению образования разнообразных физиологически активных веществ микробного происхождения. Биологический вид представляет единство специфических морфологических и физиолого-биохимических признаков организма, определяющих все особенности его жизнедеятельности, распространения и взаимодействия с внешней средой. В связи с этим образование того или иного продукта жизнедеятельности, как и характерные биологические особенности, невозможно представить в отрыве от видовой принадлежности микроорганизма.
Работы в области систематики спорообразующих бактерий и определения их положения в мире микроорганизмов начались еще до открытия спор у бактерий. Термин Bacillus на разных этапах развития микробиологии использовался вольно для обозначения как спороносных, так и неспороносных бактерий. В сущности, подобное положение сохранилось до наших дней, и мы нередко затрудняемся не только идентифицировать описанные виды, но и установить их истинную принадлежность к спорообразующим бактериям. Многие спорообразующие бактерии именовались различными авторами под родовыми названиями, которые в настоящее время служат обозначением родов неспороносных бактерий и других микроорганизмов, что еще более осложняет точное представление об описываемом организме.
Таксономия бактерий раннего периода в основном была конструктивной и имела диагностическое назначение. На этом этапе рассматривались подходы к созданию крупных систематических категорий.
По мере накопления фактического материала начали предпринимать попытки классификации по аналитическому принципу, учитывая родственные взаимоотношения микроорганизмов.
Систематика спорообразующих бактерий развивалась по мере эволюции взглядов на принципы дифференциации и идентификации микробных видов, а также усовершенствования методов морфолого-физиологического изучения бактерий.
Наиболее ранними в этом отношении были попытки микробиологов разграничить виды спорообразующих бактерий по морфологическим признакам, в частности по форме спор, способу их прорастания и т. п. Малозначимость этих признаков дифференциации и их неспецифичность привели к тому, что в дополнение к предыдущим описаниям было идентифицировано много новых видов, большинство из которых в последующем не были приняты или трактуются сейчас как синонимы других систематических категорий.
Широкое распространение спорообразующих бактерий в окружающей среде и их частое обнаружение в различных продуктах, особенно при порче, вызвали к ним определенный интерес. Первые работы по классификации этой группы бактерий были выполнены в основном представителями пищевой и санитарной микробиологии. При этом одни авторы основывались на морфологических признаках микроорганизмов, а другие — на физиологических. Классификация, основанная на различиях в способности аэробных спорообразующих бактерий сбраживать субстраты, предусматривала подразделение этих организмов на три группы по способности сбраживать глюкозу и образовывать ацетилметилкарбинол. Согласно другой классификации, которую в настоящее время используют наиболее часто, данный род бактерий разделяется на три группы по соотношению поперечных размеров спор и вегетативных клеток. Группа I — наиболее обширная — включает виды спороносных бактерий, у которых не отмечается отчетливого раздувания спорангия в процессе образования спор. Группа II объединяет бактерии, образующие овальные споры, раздувающие спорангий. Группа III охватывает бациллярные виды, характеризующиеся округлыми или шаровидными спорами, раздувающими спорангий; объединяет редко встречающиеся виды спорообразующих бактерий.
Вопросы классификации различных видов аэробных спорообразующих бактерий разрабатывались многими отечественными авторами. Особенно тщательно были изучены морфолого-физиологические особенности отдельных групп и видов этих бактерий Е. Н. Мишустиным с сотрудниками. Данные этих исследований свидетельствуют о большом многообразии видов и экологических разновидностей спорообразующих бактерий в зависимости от мест их обитания, почвенно-климатической зональности и микробного ценоза разных типов почв.
В настоящее время для определения видов спорообразующих бактерий наряду с морфоло-го-физиологическими особенностями используют и многие другие признаки.
Важными критериями для определения и дифференциации бактерий являются отношение к действию специфичных фагов, агглютинация с гомологичными сыворотками к споровому, соматическому и жгутиковому антигенам, рост при высокой концентрации солей, различной температуре и т. п. Многие отмеченные особенности применяются для внутривидового подразделения и выделения культур спороносных бактерий в отдельные разновидности, серотипы и другие мелкие систематические подразделения. В ряде случаев некоторые признаки служат основой для выделения культур спорообразующих бактерий в новые виды. Так, например, в качестве новых видов описаны психрофильные, развивающиеся при низкой температуре культуры спорообразующих бактерий. Подобным же образом выделены некоторые активные продуценты амилолитических и целлюлолитических ферментов. В литературе было описано много новых видов бацилл, патогенных для некоторых насекомых, растений и животных, что в большинстве случаев не подтвердилось в последующие годы.
Успехи в области создания счетно-вычислительной техники дали основу для быстрой математической обработки данных по родству и отдаленности организмов. Применение этой техники в бактериальной таксономии получило название числовой таксономии и было введено в микробиологию в последние годы. Числовая таксономия рассматривает группирование и идентификацию организмов с учетом их подобия при анализе не менее чем 50—60 объективных признаков. Этот метод с разработкой схем подобия и разграничения уже использован рядом авторов для систематики различных видов спороносных бактерий.
Особого внимания заслуживает разработка новых подходов к трактовке вопросов филогенетической таксономии бактерий с помощью биохимических исследований. Наибольший интерес в этом отношении представляют попытки классификации бактерий с использованием новейших данных молекулярной биологии.
Биология аэробных спорообразующих бактерий
Клетки аэробных спорообразующих бактерий имеют палочковидную форму и в сравнении с неспороносными бактериями, как правило, более крупных размеров. Вегетативные формы спороносных бактерий обладают более слабым активным движением, хотя им присущи пери-трихиально расположенные жгутики. Длина клеток вегетативных форм варьирует, особенно в зависимости от возраста культуры. У некоторых видов спороносных бактерий в старых культурах отмечается образование характерных полиморфных форм. Размеры и форма бактериальных клеток подвергаются значительным изменениям в процессе образования спор, что во многих случаях может служить дополнительным признаком для распознавания отдельных видов. В молодых культурах содержимое клеток однородно, по мере старения гомогенность исчезает, появляется зернистость. При этом отмечается значительное накопление внутриклеточного жира, который выявляется при специфическом цитохимическом окрашивании в виде зерен различной формы. Количество и характер свободного внутриклеточного жира различны у разных видов спороносных бактерий и, по мнению ряда авторов, могут быть использованы для определения видовой и групповой принадлежности бактерий.
Форма и величина спор — постоянные признаки — имеют первостепенное значение при групповом и видовом разграничении спорообразующих бактерий. Немаловажное значение при этом придается соотношению поперечных размеров спор и клеток, а также локализации спор. Спорулирующая клетка, или спорангий, у отдельных видов бактерий раздувается в месте расположения спор, если поперечник спорангия больше поперечника клетки. В зависимости от расположения спор, раздувающих спорангий, клетки принимают либо плектридиальную, либо клостридиальную форму.
Споры бактерий в благоприятных условиях прорастают, причем в характере прорастания отмечается постоянство, присущее определенным видам. Различают полярное и экваториальное прорастание спор. Как редкое исключение наблюдается косое прорастание. Сказанное относится к спорам продолговатой формы. Наблюдения показали, что некоторые виды бактерий имеют строго определенный тип прорастания спор; у отдельных видов наблюдаются и отклонения. Помимо места, откуда происходит прорастание, для различных видов характерными являются отдельные цитологические изменения, происходящие в процессе прорастания и сбрасывания (разрывания или пробивания) оболочки споры. Эти особенности прорастания спор впервые были отмечены в конце прошлого столетия И. И. Мечниковым.
Для различных видов спороносных бактерий характерны культуральные особенности роста на питательных средах. При росте на твердых средах на поверхности образуются своеобразные скопления клеток в виде отдельных бактериальных колоний. Строение колоний зависит от состава питательной среды и условий культивирования, особенностей биохимической деятельности и химического состава бактерий, интенсивности их роста, особенностей движения после деления.
Форма поверхности колоний спорообразующих бактерий самая разнообразная: гладкая жирноблестящая, плоская зернистая или крупинчатая, пленчатая влажноблестящая, сухая мучнистая, складчато-морщинистая и т. п. Один и тот же вид спороносных бактерий образует на средах различного состава разнообразные колонии. Поэтому при описании культуральных особенностей выращиваемых бактерий строго придерживаются определенного состава питательных сред и условий выращивания.
Для большинства спорообразующих бактерий очень подходящи среды, содержащие усвояемые углеводные и сложные органические соединения. С этой целью успешно могут быть использованы мясо-пептонный агар с глюкозой, сахарозой (1—2%), сусло-агар и т. п. Некоторые виды спорообразующих бактерий образуют на твердых питательных средах подвижные колонии. Природа этого явления пока недостаточно изучена, но показано, что оно связано с усиленной подвижностью клеток и некоторыми физико-химическими особенностями питательной среды.
Важным диагностическим признаком для определения видов спороносных бактерий является строение края колоний. Одни виды образуют колонии с ризоидными, бахромчатыми и ветвистыми краями, другие — с гладкими округлыми или бугристыми, грубо волнистыми. Подобные особенности в ряде случаев удается подметить невооруженным глазом, но особенно хорошо они выявляются при микроскопии с небольшим увеличением.
Консистенция бактериальных колоний весьма разнообразна. Культуры группы картофельного и сенного бацилла характеризуются образованием плотных, вросших в агар, сухих морщинистых колоний. У других видов бактерий колонии пастообразные или слизеобразу-ющие, гладкие. Образование пигментов у спорообразующих бактерий отмечается сравнительно редко. Некоторые культуры бактерий при росте на белковых средах приобретают бурую пигментацию, диффундирующую в субстрат. Подобное окрашивание не связано с образованием пигмента, а вызвано продуктами распада сложных органических соединений.
При культивировании сибиреязвенного бацилла на жидких средах отмечается выделение пигментов красного и бурого цвета. У отдельных культур сенного бацилла и некоторых других видов наблюдается образование красного пигмента, который был идентифицирован как пульхеримин и пульхериминовая кислота.
При росте на жидких питательных средах одни виды спороносных бактерий образуют поверхностную пленку, другие — нет. Культуры Вас. mycoides образуют характерную паутиновидную пленку, которая в пробирке располагается в форме конуса основанием вверх. Культуры бактерий, характеризующиеся образованием поверхностной пленки, при потере спорообразования лишаются этой способности.
Культуральные особенности роста различных видов спорообразующих бактерий, равно как и других микроорганизмов, отражают их характерные физиолого-биохимические свойства, особенности деления, размножения и расположения клеток. Отличительные особенности распределения клеток в процессе их размножения в колониях бактерий на-иболее четко выявляются при наблюдении в сканирующем микроскопе (табл. 37). Аэробные спорообразующие бактерии относятся к гетеротрофам, т. е. к микроорганизмам, нуждающимся в готовых органических соединениях. Для огромного большинства споро-образующих бактерий лучшими источниками азотного питания являются белки и аминокислоты сложных органических соединений. На средах с минеральными соединениями азота большинство этих бактерий развивается слабо.
Спорообразующие бактерии обладают активными протеолитическими ферментами. Они разлагают сложные белковые соединения на аминокислоты, а затем и на более простые азотистые вещества и аммиак. Способность спорообразующих бактерий к энергичному разложению сложных органических соединений до простых продуктов распада стала основой для физиологической характеристики этой группы бактерий как активных аммонификаторов. Однако различные виды спорообразующих бактерий по-разному относятся к источникам азотистого питания. Так, например, культуры группы сенного и картофельного бацилла более энергично сбраживают углеводы с образованием разнообразных промежуточных соединений. Для наиболее распространенных видов спорообразующих бактерий лучшими источниками азотного питания оказались пептон, гидролизат казеина, автолизат дрожжей и мочевина.
Среди почвенных аэробных спорообразующих бактерий имеются виды, которые довольно хорошо развиваются на безазотистой среде. К ним относятся олигонитрофильные бактерии, обладающие способностью усваивать атмосферный азот. Эти микроорганизмы характеризуются слабой азотфиксирующей способностью, однако их накопление в почве может значительно содействовать обогащению ее азотом. В этом отношении всестороннее изучение данной группы микроорганизмов представляет большое значение для повышения плодородия почв.
Большинство видов спорообразующих бактерий, широко распространенных в почве, обладает способностью использовать в качестве источника азота нитраты. Благодаря этому они вызывают процессы восстановления нитратов (денитрификацию) и переводят их в состав органических азотистых соединений. Таким образом, спорообразующие бактерии усваивают азот из различных источников в неодинаковой степени. Одни предпочитают аммонийный азот, другие — азот аминокислот; многие хорошо потребляют азот нитратов, тогда как некоторыми он не усваивается или используется слабо.
Активная аммонифицирующая деятельность спорообразующих бактерий имеет важное значение для повышения плодородия почв. Некоторые авторы отметили заметное увеличение урожайности растений при внесении в почву активных аммонификаторов. Спорообразующим бактериям принадлежит важная роль в превращениях фосфора. Многими авторами было показано, что культуры различных видов спороносных бактерий активно переводят нерастворимые фосфорные соединения в растворимые. В Советском Союзе с применением культуры спорообразующих бактерий, активно минерализующей сложные органические соединения фосфора, было налажено промышленное производство бактериального удобрения — фосфобактерина. Этот препарат широко и успешно применялся для повышения урожайности многих сельскохозяйственных культур.
Установлено несколько механизмов разложения фосфорных соединений спороносными бактериями. В одном случае происходит растворение трикальцийфосфата, в другом — перевод фосфоритов в апатиты или фосфитов в фосфаты. Более распространенным является минерализация органофосфатов в результате ферментативной деятельности бактерий и выделения ими кислот. Результаты исследований показывают, что отмеченные свойства не приурочены к особым видам, обнаруживаются у культур многих видов и разновидностей спороносных бактерий, а также других микроорганизмов.
Отечественными авторами были выделены и изучены культуры спорообразующих бактерий, способные разрушать полевые шпаты, каолин и другие формы силикатов.
Среди спорообразующих бактерий обнаружены виды и разновидности, характеризующиеся выраженной специализацией биохимической активности. Так, культуры Вас. pasteurii обладают уреазной активностью и хорошо развиваются в сильно щелочной среде. Редкой формой бациллярных организмов является Вас. fastidiosus, который не способен усваивать сахара, аминокислоты, белковые и другие соединения. Бактерии этого вида потребляют лишь мочевую кислоту и аллантоин.
В качестве источника углеродного питания спорообразующие бактерии могут использовать как простые сахара, так и полисахариды. Из моносахаридов лучше всего они усваивают глюкозу, а из дисахаридов — сахарозу. Отношение разных видов спорообразующих бактерий к углеводам различное, что широко используется в исследованиях по систематике для определения видовой принадлежности микроорганизмов. При развитии на простых сахарах, в особенности на глюкозе, спорообразующие бактерии синтезируют ряд продуктов — молочную, уксусную и пропионовую кислоты, ацетилметилкарбинол и т. п. Газообразование отмечается только у культур нескольких видов. Многие виды спорообразующих бактерий сравнительно хорошо усваивают различные органические кислоты и спирты.
В группе аэробных спорообразующих бактерий немало видов и разновидностей, которые для своего роста и развития нуждаются в различных витаминах, аминокислотах и других ростовых факторах. Так, для культур сибиреязвенного бацилла наряду с аминокислотами необходим тиамин. Культуры облигатных энто-мопатогенных видов — возбудителей молочной болезни японского жука, американского гнильца медоносной пчелы и других болезней насекомых — нуждаются во многих аминокислотах и витаминах.
Культуры сапрофитных спорообразующих бактерий также в ряде случаев проявляют специфические потребности в витаминном и аминокислотном питании. Наиболее характерной для подобных организмов является зависимость их роста и развития от наличия в среде тиамина, биотина, фо-лиевой и никотиновой кислот. В качестве обособленного нового вида описаны культуры спорообразующих бактерий, нуждающиеся в пан-тотеновой кислоте. Термофильным формам спороносных бактерий присуща более выраженная зависимость роста и развития от аминокислот, витаминов и других дополнительных факторов роста.
Спорообразующие бактерии — активные продуценты многих ферментов.
Бактерии группы сенного и картофельного бацилла обладают выраженной протеолитиче-ской и амилолитической активностью. В настоящее время культуры этих видов спороносных бактерий широко используются во многих странах для промышленной выработки амилазы и различных протеаз. С давних времен в Японии большой популярностью пользуется национальное блюдо «натто», которое изготовляют из соевых бобов при их обработке культурой сенного бацилла.
Некоторые виды спорообразующих бактерий вырабатывают ферменты, разлагающие пектин и протопектин растений. Этим бактериям при-писывается определенная роль в создании комковатой структуры почв и в образовании клубеньков у бобовых растений.
Выраженные ферментативные свойства некоторых видов спорообразующих бактерий обусловливают развитие гнилей и побурение плодов, фруктов и других растительных продуктов. При благоприятных условиях размножения некоторых видов бацилл — продуцентов фосфолипаз и других ферментов — вызывается порча пищевых продуктов, которые могут служить причиной гастроэнтеритов и других пищевых отравлений.
Среди бактериальных организмов группа аэробных спорообразующих бактерий известна своими сильно выраженными антагонистическими свойствами в отношении большого числа микроорганизмов. Спороносные бактерии можно поставить в один ряд с лучистыми грибками, пенициллами и аспергиллами, представляющими собой основные источники получения антибиотических веществ.
Подавляющее большинство антибиотиков бактериального происхождения выделено из группы спорообразующих бактерий. Первый антибиотический препарат — грамицидин — выделен из культуры спороносной бактерии. Советскими учеными был получен антибиотик грамицидин С, который успешно используется при лечении многих инфекций. Из различных видов бацилл получены антибиотики альвеин, бациллин, бацитрацин, лихениформин, субтилин, циркулин и др. Особый интерес вызвало открытие полимиксинов — антибиотиков бациллярного происхождения, которые оказались высокоактивными против грамотрицательных бактерий. В ряде стран организовано промышленное производство отдельных препаратов антибиотиков: полимиксина В, колистина, бацитрацина.
Кроме терапевтического использования, бацитрацин применяется в качестве стимулятора роста животных.
В настоящее время из различных видов спорообразующих бактерий выделено более 60 антибиотиков, из которых некоторые были испытаны в клинической практике. Однако антибиотики, полученные из спорообразующих бактерий, изучены недостаточно.
За некоторыми исключениями, антибиотики из спорообразующих бактерий представляют собой вещества белковой природы — полипептиды. Они состоят из различных аминокислот, причем наиболее характерным является то, что в состав полипептидных антибиотиков входят неестественные аминокислоты с правой оптической конфигурацией. Некоторые антибиотики полипептидной природы имеют сравнительно более простой состав и несложную формулу, представляя весьма удобную модель для изучения строения белка. С другой стороны, полипептидные антибиотики привлекают большой интерес биохимиков, так как эти вещества могут быть использованы при изучении одной из центральных проблем современной биологии — выяснении причин, обусловливающих специфичность биологически активного белка.
По механизму действия продуцируемые спорообразующими бактериями антибиотики разделяются на три группы. Группа эдеинов, представляющих собой пептиды с сильно основными свойствами, специфически подавляет синтез ДНК. Группа бацитрацинов и родственных им антибиотиков представляет собой циклические пептиды, которые угнетают синтез оболочки клеток. В обширную группу бациллярных антибиотиков включают грамицидины, поли-миксины и родственные им соединения, которые специфически блокируют синтез структурных компонентов или функцию клеточной мембраны. Характерной особенностью этих антибиотиков является то, что они образуются после активного размножения бактерий в процессе спорообразования. Результаты генетических исследований свидетельствуют, что биосинтез бациллярных антибиотиков тесно связан с образованием протеазы, характерной для процессов спорообразования. Поэтому синтез антибиотиков отражает особенности биохимической дифференциации клеток спорообразующих бактерий.
Спорообразующие бактерии широко распространены в природе и играют большую роль в биологии почвы; изучение антагонистических свойств спороносных бактерий внесет много ценного в наши представления о роли антагонизма микробов в процессах самоочищения почвы, воды и других природных субстратов.
Энтомопатогенные аэробные спорообразующие бактерии
Спорообразующие бактерии, обладающие энтомопатогенным действием, относятся, как правило, к группе аэробных микроорганизмов. Имеются лишь единичные описания анаэробных энтомопатогенных спорообразующих бактерий. Энтомопатогенные аэробные Спорообразующие бактерии можно условно подразделить на две группы: облигатные формы и факультативные.
В группу облигатных входят виды бактерий— возбудителей болезней насекомых, специфически приспособившихся к условиям обитания в организме насекомых. Например, Вас. ро-pilliae и Вас. lentimorbus вызывают так называемую молочную болезнь японского жука; Вас. larvae — возбудитель американского гнильца медоносной пчелы.
Группа факультативных или условно энтомопатогенных спорообразующих бактерий весьма разнообразна по составу и включает большое число видов. Сюда относят ряд энтомо-фильных видов, часто встречающихся в микрофлоре насекомых и играющих важную роль в этиопатогенезе различных инфекций у насекомых, — Вас. alvei, Вас. orpheus, Вас. subrugosum и многие другие. Весьма условно могут трактоваться как факультативно энтомопатогенные микроорганизмы культуры широко распространенного вида Вас. cereus со многими разновидностями.
Особую группу составляют спорообразую-щие бактерии, объединяемые в вид Вас. thuringiensis, который включает многие разновидности спорообразующих бактерий, вырабатывающих особые энтомоцидные токсины кристалловидной природы. Эти бактерии используют для промышленного получения инсектицидных препаратов.
Наконец, как факультативно или, точнее, потенциально Энтомопатогенные формы должны рассматриваться многие виды спорообразующих бактерий, которые вызывают гибель насекомых при проникновении в организм и развитии в их гемолимфе. В основе энтомопа-тогенного действия спорообразующих бактерий, развивающихся в полости тела насекомых, лежит неспецифический механизм действия, связанный с продуцированием ими ряда ферментов. Энтомопатогенное действие этих бактерий может быть обусловлено или образованием ряда физиологически активных соединений, например токсичных антибиотиков, или специфическими метаболитическими взаимодействиями с организмом насекомых. Литература по энтомологии изобилует описаниями многих новых видов спорообразующих бактерий, трактуемых различными авторами как энтомопатогенные. В большинстве случаев при описании этих видов авторы руководствовались лабораторными наблюдениями над их патогенным действием на отдельных насекомых, а очень часто только тем, что эти микроорганизмы были выделены из погибших насекомых. Трактовка культур как новых видов сопровождалась поверхностным изучением их, а малозначимые отличительные признаки рассматривались как основа для выделения их из известных видов бактерий.
Однако анализ фактического материала, накопленного в этой области, показывает, что, за исключением упомянутых выше облигатно энтомопатогенных форм и некоторых других видов, большинство описанных энтомопатогенных спороносных бактерий является представителями ранее описанных видов и разновидностей.
Группа облигатных энтомопатогенных бактерий — Вас. popilliae-lentimorbus, Вас. larvae — характеризуется общими признаками, принципиально важными для установления их родства. Все они морфологически близки — при развитии вегетативных клеток образуются споры, раздувающие спорангий; грамвариабильны. Культуры этих видов требуют для своего развития присутствия в среде аминокислот, тиамина и биотина, очень трудно растут на обычных лабораторных средах. Это указывает на более узкую биохимическую специализацию этих видов.
Культуры энтомофильных видов — Вас. alvei, Вас. para-alvei, Вас. pulvifaciens — примыкают к указанным видам по общим признакам. Бактерии этих видов также являются витаминза-висимыми, хотя хорошо развиваются и на обычных белковых средах.
Вид Вас. orpheus (Вас. laterosporus) сравнительно мало изучен. Его систематическое разграничение основывается на своеобразном характере спорообразования, при котором зрелая спора практически представляет собой спорангий с остатком клетки, окаймляющей спору в виде полулуния. Подобное явление иногда обнаруживается и в культурах других видов.
Общепризнано биологическое и систематическое родство энтомопатогенных спорообразующих бактерий Вас. cereus, Вас. thuringiensis и многочисленных их разновидностей. Потеря способности образовывать энтомоцидные токсины лежит в основе отграничения Вас. thuringiensis от Вас. cereus. Бактерии этих видов имеют много общего по культуральным, морфологическим и физиологическим особенностям. Как правило, строго обязательной является потребность в присутствии аминокислот. Вита-минзависимые штаммы обнаруживаются у отдельных разновидностей. Паразитизм у энтомопатогенных бактерий сопровождается развитием у них биохимической дифференциации, выражающейся в более узкой специализации питания. Облигатные формы этих микроорганизмов характеризуются зависимостью от многих аминокислот, витаминов и других факторов роста, тогда как сапрофитные и условно патогенные энтомопатогенные виды, как правило, являются ауксоавтотроф-ными, т. е. не нуждаются в дополнительных факторах роста.
Культуры спорообразующих бактерий, объединяемые в вид Вас. thuringiensis, приобретают в настоящее время особо важное значение в связи с организацией на основе их использования промышленного производства высокоэффективных инсектицидов. Этот вид включает ряд разновидностей, отличающихся друг от друга морфо лого-физиологическими особенностями, а также энтомопатогенной активностью к насекомым. В настоящее время общепринятой является внутривидовая дифференциация Вас. thuringiensis на серотипы по сероагглютинации к жгутиковому антигену отдельных культур бактерий. Подобное разграничение проводится и по многим другим отличительным особенностям бактерий. Некоторые разновидности этого вида образуют энтомоцидный токсин нуклеотидной природы, который, в отличие от кристалловидного токсина, находится в растворимом состоянии в культуральной жидкости бактерий и не разрушается при кипячении.
При внутривидовом разграничении культур этого вида учитываются и многие другие признаки, обычно используемые для определения микроорганизмов. Энтомопатогенные спорообразующие бактерии являются возбудителями болезней тутового шелкопряда, наносят огромный вред шелководству. Они широко распространены в почве, эпифитной микрофлоре листа шелковицы и обнаруживаются в нормальной микрофлоре гусениц тутового шелкопряда. При благоприятных для развития условиях эти микроорганизмы вызывают гибель гусениц, что в ряде случаев приводит к быстрому распространению инфекции. Вызываемое инфекцией заболевание гусениц проявляется, как правило, в последнем возрасте гусениц или в период окукливания. Значительный ущерб, наносимый шелководству, обусловлен бактериальными болезнями бациллярного происхождения. Энтомопатогенные спорообразующие бактерии — возбудители бактериозов тутового шелкопряда — особенно часто обнаруживаются в южных районах шелководства.
Бактерии вида Вас. thuringiensis, продуцирующие энтомоцидные кристалловидные токсины, в большинстве случаев обитают среди кишечной микрофлоры различных насекомых. Однако обнаружены и определенные эколого-географические ареалы распространения отдельных разновидностей. Приспособленность этих бактерий к среде обитания и условиям существования специфична.
Вредоносность аэробных спорообразующих бактерий и их патогенные свойства
Различные виды спорообразующих бактерий широко распространены в окружающей среде и нередко рассматривались как возбудители разнообразных процессов порчи пищевых продуктов.
Спорообразующие бактерии стали важным объектом исследований в связи с развитием консервной промышленности. Было выполнено много работ по изучению устойчивости и выживаемости бактериальных спор при различных методах консервирования продуктов. Особое внимание уделялось изучению анаэробных видов спорообразующих бактерий, в частности ботулиническому бациллу, который образует ботулинический яд, вызывающий тяжелые пищевые отравления.
Различные виды аэробных спорообразующих бактерий, особенно термофильные формы, вызывают порчу консервированных продуктов, например сгущенного молока, а также различных кондитерских изделий. Вас. coagulans, особенно его термофильные формы, обладающие способностью развиваться в кислой среде, вызывают порчу томатов.
Весьма распространенными формами спорообразующих бактерий, вызывающих порчу консервированных продуктов, являются также бактерии группы сенного и картофельного бацилла. Эти бактерии широко распространены в почве и воздухе, постоянно загрязняют пищевые продукты, а также материалы и сырье, используемые для их выработки. Описаны случаи порчи консервов с бомбажем банок, при которых отмечалось массовое распространение бактерий группы сенного бацилла. По наблюдениям многих авторов, процент порчи консервированных продуктов находится в прямой зависимости от обсемененности их споро-образующими бактериями перед стерилизацией,особенно часто это обнаруживается в овощных консервах, загрязненных почвенной микрофлорой.
При микробиологических исследованиях ряда консервированных продуктов, подвергшихся порче, обнаружено значительное количество спороносных бактерий группы сенного и картофельного бацилла. Среди них нередко преобладают солестойкие (галофильные) и кислотоустойчивые формы с выраженными ферментативными свойствами.
При порче пищевых продуктов происходит ферментативный распад белковых и липидных компонентов с образованием вредных соединений. Поэтому использование в пищевой и консервной промышленности некоторых добавок, например агара и желатина, способствует в ряде случаев порче ряда кулинарных изделий и продуктов.
Аэробные спорообразующие бактерии неоднократно являлись причиной порчи консервируемых продуктов крови. Отмечены случаи смертельных исходов при использовании испорченной консервированной крови и плазмы главным образом бактериями из группы сенного и картофельного бацилла. В этих случаях основная роль в порче подобных продуктов принадлежит таким ферментам, как гемолизины.
Распространенными возбудителями порчи различных пищевых и кулинарных изделий, а также молочных продуктов являются часто встречающиеся в природе спорообразующие бактерии, объединяемые в вид Вас. cereus. В литературе описаны случаи пищевых отравлений, вызванных этими бактериями, которые, как правило, не смертельны. Пищевые расстройства и токсические явления, развивающиеся после потребления в пищу подвергшихся порче продуктов, связывают с действием ферментов группы фосфолипаз.
Бактерии этого вида постоянно обнаруживаются при анализах пищевых продуктов, особенно полуфабрикатов и готовых кулинарных изделий. Источником загрязнений микроорганизмами являются воздух и различные предметы окружающей среды. При хранении пищевых продуктов в отсутствие холода всегда создаются благоприятные условия для развития и массового размножения бактерий.
Среди аэробных спорообразующих бактерий типично патогенным для человека и животных является только сибиреязвенный бацилл. Остальные виды этих бактерий вирулентными свойствами для теплокровных, по-видимому, не обладают. Имеющиеся сообщения о выделении различных видов спороносных бактерий при разнообразных инфекционных поражениях или болезнях не могут служить достоверным основанием для заключений о патогенности этих бактерий для животных и человека.
Вызываемые культурами некоторых видов спороносных бактерий воспалительные поражения могут рассматриваться как результат неспецифического действия активного комплекса ферментов. Энтомопатогенные штаммы данной группы бактерий также практически безвредны для человека и животных. Бактерии группы сенного и картофельного бацилла являются возбудителями болезней печеного хлеба и макарон.
Таблица 40. Пигментация у различных видов актиномицетов в пробирках и чашке Петри.
Разрушение структуры хлеба и разложение содержащихся в нем веществ связано с продуцированием бактериями группы сенной и картофельной палочки активных протеолитиче-ских и амилолитических ферментов. Одним из основных факторов, обусловливающих развитие поражений хлеба, является накопление в зерне и муке спороносных бактерий группы картофельного бацилла. Спороносным бактериям, особенно их термофильным формам, отводится значительная роль в процессах самосогревания зерна.
Некоторые виды спорообразующих бактерий, обладающие выраженными протопекти-назными и протеолитическими свойствами, обладают фитопатогенным действием. Ткани пораженных растений и плодов подвергаются мацерации, болезнь выражается в побурении или загнивании.

Таблица 41. Действие антибиотика актиномицетного происхождения на непарного шелкопряда: 1—лиственница, не пораженная шелкопрядом; 2, 3 — лиственницы, пораженные шелкопрядом; 4 — дубовые ветки, обработанные антибиотиком и зараженные шелкопрядом; 5 — дубовые ветки (контроль); 6 — бабочка шелкопряда.
Большинство описанных фитопатогенных культур относится к группе картофельной бациллы. Эта бактерия поражает различные растения: лен, тыкву, кукурузу, свеклу, плоды апельсина, абрикоса, кабачков и других растений, клубни картофеля, семенники капусты, коробочки хлопчатника. Показано, что картофельный бацилл может вызвать бактериоз початков кукурузы, при искусственном заражении ими бактериями происходило типичное побурение сосудистого пучка кок-сагыза. Из загнивших плодов томатов выделен штамм спорообразующей бактерии, по-видимому, родственной культурам сенного бацилла.
Другой группой спорообразующих бактерий, вызывающих поражения растений, являются Вас. macerans, Вас. polymyxa. Родственный этой группе вид вызывает бактериоз льна. Описаны поражения картофеля, моркови, лука, огурцов и других растений и плодов, вызываемые этими бактериями. Ведущим фактором в этиопатогенезе этих поражений являются ферменты, разлагающие пектин и протопектин.
Применение бактерий рода Bacillus для борьбы с вредоносными насекомыми
Микробиологический метод борьбы с вредоносными насекомыми, именуемый сокращенно микробиометодом, основан на использовании энтомопатогенных микроорганизмов, которые являются возбудителями болезней насекомых или образуют вещества, обладающие энтомоцидным действием. Как правило, микробиометод предполагает использование препаратов живых микроорганизмов. Энтомоцидные продукты жизнедеятельности микроорганизмов не получили пока широкого практического применения.
Современное промышленное производство препаратов микробных инсектицидов основано на использовании в основном двух видов энтомопатогенных бактерий — Вас. thuringiensis и Вас. popilliae.
В 1874 г. Луи Пастер предложил использовать энтомопатогенные бактерии для борьбы с филлоксерой. И. И. Мечников в 1879 г. описал возбудителей бактериальной и грибной болезней хлебного жука и провел успешные опыты по использованию их против этого вредителя. Развивая эти исследования, И. М. Красильщик организовал в 80-х годах прошлого столетия лабораторию по производству и применению микробов, обладавших энтомопатогенным действием; ученый установил губительное действие некоторых микробов на хлебного жука и ряд других вредителей.
В последующие годы были описаны возбудители многих болезней насекомых, некоторые культуры энтомопатогенных микробов использовались с переменным успехом для борьбы с вредоносными насекомыми в широких масштабах. Широкий отклик получили работы Д' Эрелля (1911) по использованию выделенной им культуры неспороносной бактерии для борьбы с саранчой в некоторых странах Южной Америки и Северной Африки.
Для развития микробиометода особенно ценными явились работы С. Метальникова, В. Шорина и К. Туманова. В 1922 —1942 гг. ими было выделено и изучено большое число энтомопатогенных форм спорообразующих бактерий, на основе которых было организовано производство инсектицидных препаратов для борьбы с опасными вредителями кукурузы, винограда и хлопчатника.
В 1941 г. в США, используя культуры возбудителей так называемых молочных болезней насекомых, Датки разработал и успешно применил метод получения нового инсектицидного препарата для борьбы с японским жуком.
В 1949 г. Е. В. Талалаев разработал и внедрил в широкую практику метод борьбы с сибирским шелкопрядом с помощью культуры спорообразующей бактерии, принадлежащей к виду Вас. thuringiensis. Открытие в 1953 г. Хэннейем энтомоцидной природы кристалловидных включений у бактерий этого вида положило начало широким исследованиям по использованию его при получении новых эффективных инсектицидных препаратов. В 1959—1960 гг. в СССР, США, Франции было организовано промышленное производство специальных препаратов бактериальных инсектицидов из культур разновидностей Вас. thuringiensis. Микробные и в первую очередь бактериальные инсектициды прочно входят в систему мероприятий по защите растений и широко используются в борьбе со многими вредителями сельского хозяйства.
На основе использования культуры новой разновидности Вас. thuringiensis была разработана технология получения препарата бактериального инсектицида-энтобактерина, промышленное изготовление которого в нашей стране осуществляется с 1959 г. В настоящее время энтобактерин широко применяется для борьбы со многими видами вредоносных насекомых.
В настоящее время основное внимание уделяется получению высокоэффективных культур энтомопатогенных микроорганизмов. Большое значение имеет выявление природы энто-моцидных веществ из микроорганизмов, изучение их строения, механизмов биосинтеза и специфики действия на насекомых. Особую группу энтомопатогенных бактерий составляют виды, продуцирующие энтомоцид-ные токсины при развитии на обычных питательных средах. Наибольший интерес из этой группы представляют аэробные спорообра-зующие бактерии, объединяемые в вид Вас. thuringiensis. Использование бактерий этого вида составляет основу современной промышленности, выпускающей микробные инсектициды.
Характерной особенностью этих бактерий Вас. thuringiensis является их способность продуцировать специфические кристалловидные токсины, обладающие высокой энтомоцидной активностью. Кристаллы имеют ромбовидную (тетрагональную) форму, обнаружива- ются внутри клеток в процессе споруляции с помощью обычной микроскопии живых препаратов бактерий, и их часто именуют как па-распоральные включения или эндотоксины. После завершения процесса образования спор токсины выделяются в среду и обнаруживаются в свободном виде. Величина кристаллов варьирует в зависимости от вида культур бактерий в пределах 1—3 мкм. Энтомоцидные кристаллы — вещества белковой природы, в их состав входят 18 аминокислот. Энтомоцидный кристалл — термолабильный белок, разрушается при температуре около 60° С. Энтомоцидные кристаллы токсичны для чешуекрылых насекомых лишь при пероральном введении: вызывают паралич средней кишки гусениц. Насекомые гибнут при обработке их растворами токсинов очень малой концентрации — введение 1 : 106 и более.
Неоспоримым преимуществом этих препаратов является отсутствие токсического действия на энтомофаги и полезную энтомофауну. Так, они безвредны для медоносной пчелы. Препараты кристалловидных токсинов безвредны для теплокровных животных, рыб и растений. Кроме кристалловидных токсинов, бактерии некоторых разновидностей Вас. thuringiensis выделяют в среду растворимые в воде Энтомоцидные вещества, из которых наибольший интерес представляет термостабильный токсин, или бета-экзотоксин. В отличие от энтомоцид-ных кристаллов это вещество не разрушается даже при 100—120 °С. Оно является сравнительно низкомолекулярным соединением нук-леотидной природы. В составе термостабильного экзотоксина обнаружены два родственных вещества, названных турингиензииами,— А и В. Энтомоцидное действие термостабильного экзотоксина менее специфично — он активен по отношению ко многим видам насекомых. Практический интерес представляет его энтомоцид-ное действие на мух, комаров, совок и некоторых других вредных насекомых. Препараты экзотоксина безвредны для теплокровных животных, рыб и растений.
Микробиологическая промышленность изготовляет инсектицидные препараты из культур некоторых разновидностей Вас. thuringiensis. В нашей стране известны препараты энтобак-терин-3, дендробациллин, инсектин; за границей — биотрол, турицид, агритрол, бактан, ди-пел, спореин и др. Бактериальные инсектициды чаще всего выпускаются в виде порошка. Порошки более эффективны, транспортабельны, удобны для хранения и сохраняют свою активность в течение нескольких лет.
Несомненным преимуществом обладают гранулированные и инкапсулированные формы бактериальных препаратов, с успехом использованные против ряда вредителей. Так, применяются препараты в гранулах с кукурузной мукой, которые эффективны против кукурузного мотылька. Такая форма препаратов позволяет избежать возможное пагубное влияние инсектицидов на полезную энтомофауну.
При производстве инсектицидных препаратов применяются разнообразные добавки (растека-тели, прилипатели или распылители), которые значительно повышают эффективность используемого бактериального инсектицида. Энтомо-цидная активность таких препаратов превышает исходную при одинаковом содержании спор и энтомоцидных кристаллов.
Энтомоцидное действие препаратов из культур бактерий Вас. thuringiensis распространяется в основном на чешуекрылых; число чувствительных к действию Вас. thuringiensis насекомых превышает 150 видов. Насекомые из отрядов перепончатокрылых, двукрылых и жуков нечувствительны к действию этих бактерий. К наиболее вредоносным насекомым, подверженным действию препаратов Вас. thuringiensis, относятся яблонная, черемуховая, плодовая, бересклетовая, магалебская, ореховая, рябиновая, сиреневая, капустная моли; капустная и репная белянки, боярышница, ивовая волнянка, сосновый, сибирский, кольчатый, непарный шелкопряды, златогузка, листовертки, розанная, почковая, всеядная, плодовая, капустная, мельничная огневки, зимняя кустовая, желтоусая пяденица, американская белая бабочка, яблонная плодожорка, вишневый слизистый пилильщик, кукурузный мотылек, мальвовая моль, табачный бражник, коробочный червь хлопчатника. Безвредность бактериальных инсектицидов для растений позволяет применять препараты в любую фазу вегетации растений. Норма расхода препаратов зависит от вида насекомых-вредителей, метеорологических условий, размеров обрабатываемых растений, а также характера опрыскивания. Для порошковидных препаратов энтобак-терина установлены следующие дозировки: обработка овощных культур — 1,0—3,0 кг на 1 га, садовых и других культур — 3,0—5,0 кг на 1 га.
Перспективно совместное использование бактериальных инсектицидов с различными химическими средствами. При этом отмечается синергизм их энтомоцидного действия; спектр энтомоцидного действия препаратов расширяется, уменьшаются нормы их расхода.
Иммунитет и привыкание к действию энтомоцидных кристаллов и других бактериальных токсинов у чувствительных видов насекомых не отмечаются. При проникновении в кишечник насекомых достаточных доз этих соединений отмечается 100-процентная гибель вредителей.
В природе основным условием проявления вирулентных свойств энтомопатогенных микроорганизмов является массовое развитие бактерий в кишечнике чувствительных видов насекомых. Это развитие происходит во всех случаях нарушения физиологии насекомых, неблагоприятного воздействия на них внешней среды и наличия в кишечнике условий, способствующих развитию этих бактерий.
Исключительно перспективны для производства инсектицидных препаратов культуры возбудителей молочных болезней, в особенности Вас. popilliae. Культуры этого вида — очень эффективное средство борьбы с японским жуком — опаснейшим вредителем, поражающим около 300 видов растений. Бактерии выращивают непосредственно в организме личинок японского жука. Погибших, высушенных личинок вносят в почву, где споры бактерий долгое время остаются жизнеспособными и вирулентными для жука. Выращивание Вас. popilliae в организме насекомых — весьма трудоемкий процесс. В последние годы достигнут значительный успех в изучении физиологических и биохимических особенностей культур этой группы бактерий, что послужит основой для поисков способов выращивания их на искусственных питательных средах.
Методы выращивания Вас. popilliae на искусственных средах позволят получить препараты бактериальных инсектицидов для борьбы с особо вредоносными насекомыми, в том числе с жуками, хрущами и другими видами, против которых практически нет эффективных средств борьбы. Бактериальные инсектицидные препараты качественно отличны от химических инсектицидов. Они не обладают контактным действием, более специфичны и активны, кратность их применения значительно меньше, чем химических средст-в, привыкание к ним насекомых не отмечено. Вместе с тем повышение эффективности при совместном использовании бактериальных и химических инсектицидов служит основанием для разработки единой системы интегрированной борьбы с вредоносными насекомыми.
Среди микробных метаболитов, которые могут быть применены в качестве инсектицидных препаратов, определенное значение имеют токсические антибиотики. Выделен ряд антибиотиков (антимицин А, пиерицидин, деструксины и др.), обладающих широким спектром инсектицидного действия.
Порядок хламидобактерии (CHLAMYDOBACTERIALES)
К хламидобактериям относят гетеротрофные бактерии, растущие обычно в виде нитей и образующие чехлы (влагалища), где аккумулируются гидраты окиси железа. Молодые клетки, выходящие из чехла, подвижны, облададают полярным или субтерминальным жгутиком. Микроорганизмы этого порядка широко распространены в природе и бурно развиваются в тех местах, где происходит постоянное загрязнение воды и почвы пищевыми отходами.Семейство хламидобактерии (CHLAMYDOBACTERIACEAE)
Характерными представителями порядка Сhlаmydobacteriales являются организмы, относимые к семейству Chlamydobacteriaceae. Наиболее типичным среди этих организмов является род сферотилюс (Sphaerotilus). Представители этого рода — типичные обитатели сточных вод. Растут в загрязненной проточной воде, в отстойниках сахарных заводов, на плотинах и градирнях, на твердых поверхностях, где образуют наросты, напоминающие густой мех. Трубы, отстойники, сточные канавы, ямы в короткий срок забиваются этими бактериями. Типовой вид — Sphaerotilus natans — грамотрицательная бактерия с полярным жгутиком. Растет в форме нитей, формируя цепочки клеток, окруженных трубчатым чехлом, состоящим из полисахарида (чехол — разновидность капсулы).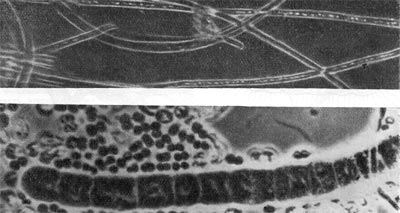
Рис. 66. Многоклеточные бактерии Beggiatoa, выделенные из разных источников (по Броку, 1970).
Клетки размножаются внутри чехла поперечным делением, после чего наружу выходят подвижные формы.
Представители другого рода — лептотрикс (Leptothrix), называемые также «охровыми бактериями», развиваются в воде, богатой железом, в канавах, дренажных трубах и болотах. В местах обитания органические вещества часто связаны с железом (комплексы). Поэтому их чехлы пропитаны железом. Сходной морфологией обладают также нитчатые бесцветные серные бактерии (род Beggiatoa) и представители других родов (Leucothrix, Thiothrix). Они отличаются от других хламидобактерий крупными размерами клеток и способностью окислять минеральные соединения серы, что послужило основанием для выделения этих нитчатых бактерий в порядок Beggiatoales (рис. 66).
Порядок кариофановые (CARYOPHANALES)
В этот порядок М. А. Пешков (1957) выделяет входившие ранее в порядок Chlamydobacteriales гетеротрофные нитчатые бактерии, сходные с сине-зелеными водорослями, но бесцветные. В отличие от хламидобактерий у Caryopha-nales жгутики расположены перитрихиально. Наиболее характерным родом семейства является кариофанон (Caryophanon), впервые описанный М. А. Пешковым. Отдельные клетки этой бактерии обладают жгутиками, и вся многоклеточная особь активно подвижна. Эти грамположительные палочки выделяются обычно из коровьего навоза. Близкие к ней по строению с крупными трихомами (члениками) представители рода осциллоспира (Oscillospira) образуют споры (рис. 67).
Хищные нитчатые бактерии
Крайне своеобразная группа хищных нитчатых бактерий впервые описана на уровне порядка Cyclobacteriales советским микробиологом Б. В. Перфильевым.Клетки этих бактерий постоянно соединены плазмодесмами. Большие группы клеток погружены в слизь и обладают способностью согласованно двигаться. В род диктиобактерий (Dictiobacter) были включены бактерии, образующие микроскопические скопления — бактериальные колонии, состоящие из 100— 200 отдельных довольно мелких клеток (1—6 мкм), связанных плазмодесмами (мостиками). Центральная полость этой группы заполнена гомогенной жидкостью. Во время движения колония захватывает живые микроорганизмы и переваривает их.
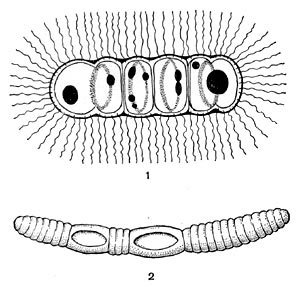
Рис. 67. Схема строения многоклеточных бактерий: 1 — Caryophanon и 2 — Oscillospira (по Пешкову, 1955).
Представители другого рода хищных бактерий — циклобактер (Gyclobacter) представляют собой также многоклеточные колонии палочек. Одной из трех стадий в цикле развития является «сетчатоарканная», когда бактерия охотится, обволакивая жертву «коконом» из клеток и разрушает ее. Третьим родом хищных бактерий является тератобактер (Teratobacter, рис. 68). Б. В. Перфильев наблюдал у этой бактерии ловчее приспособление в виде петель, которое облегчает улавливание жертв, как правило, нитчатых бактерий (в частности, Beggiatoa).
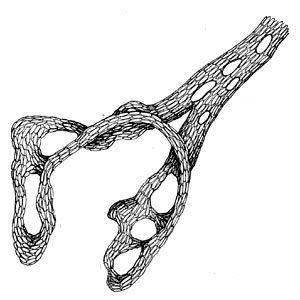
Рис. 68. Устройство ловчего приспособления хищной бактерии Teratobacter (по Перфильеву, Габе, 1961).
Бактерии, подобные описанным, довольно легко обнаружить при постановке простейших опытов. Достаточно внести в колбу с водой небольшое количество богатой органическим веществом почвы или ила, чтобы спустя 10—15 дней на поверхности воды обнаружить микроскопления клеток, соединенных плазмо-десмами в большие группы. Такая форма роста известна также под названием бактодерм, и ради объективности следует отметить, что убедительных доказательств в пользу хищной природы подобных скоплений (микроколоний) все еще недостаточно. Само существование таких многоклеточных агрегатов не вызывает сомнения и является формой существования в природе обычных сапрофитных бактерий.
Другим примером сложных нитчатых объединений клеток могут служить обнаруженные В. И. Дудо и (1972) анаэробные неспорообразующие бактерии, формирующие сложно организованные колонии, состоящие из клеток, упорядоченных в нити, взаимно переплетенных. На почвенных частицах, взятых в качестве питательной среды, эти бактерии образуют воздушные колонии, напоминающие колонии акти-номицетов. При просмотре в сканирующем электронном микроскопе (микроскоп, работающий по принципу отраженного луча) видна сетчатая структура колоний (табл. 38). Отдельные клетки соединены между собой с помощью перетяжек. Из-за задержки в делении клеток перетяжки сохраняются долго. Некоторые колонии таких организмов имеют вид белого пушка, другие — окрашены. Они образованы клетками разных размеров. Эти организмы могут расти на поверхности стекла и минералов в камерах, насыщенных парами воды. Возможно, такие микроколонии способны активно адсорбировать пары воды и запасать впрок, так как огромная «ворсистая» поверхность этих колоний вполне соответствует такой задаче. Большинство этих организмов могут развиваться на почвенных средах (агаризованная почва) с добавлением витаминов и других факторов роста.
Хищные бактерии отражают экологически адекватную (соответствующую среде обитания), но не обязательную форму роста. По-видимому, близки к этой группе и анаэробные нитчатые бактерии.
Порядок железобактерии(FERRIBACTERIALES)
Железо необходимо всем живым организмам. В природе оно существует в органических и неорганических соединениях. Главную роль в круговороте железа в природе играют микробы.
Эти процессы идут по двум каналам: 1) минерализация органических соединений, содержащих железо, при участии гетеротрофных микроорганизмов; 2) окисление восстановленных (закисных) и восстановленных окисных соединений железа.
Минерализацию железосодержащих органических веществ проводят многочисленные гетеротрофные организмы (бактерии, грибы, акти-номицеты). Только специфические возбудители — хемолитоавтотрофы — способны осуществлять второй процесс. Это — представители рода Thiobacillus — грамотрицательных аэробных бактерий. Основной процесс, проводимый ими, описывается следующей схемой: 4Fe2+++4H++02 -> 4Fe3++2H20 Для одних кислотоустойчивых бактерий (выдерживают значения рН, равные 2,5) способность к хемолитотрофному образу жизни (получению энергии за счет окисления ионов за-кисного железа) убедительно доказана. Таким организмом является представитель тионовых бактерий — Thiobacillus ferrooxidans. Для других «классических» железобактерий (например, Gallionella ferruginea) таких данных нет. Возникает сомнение, являются ли они истинными железобактериями.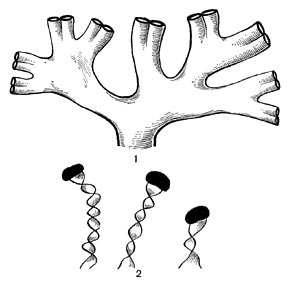
Рис. 69. Бактерии со слизистыми стебельками: 1 — Nevskia, 2 — Gallionella.
Порядок железобактерий объединяет сборную группу одноклеточных бактерий, способных аккумулировать соединения железа и марганца в результате гетеротрофных процессов. Другие организмы, способные к окислению и восстановлению соединений железа, отнесены к другим порядкам: серобактериям (род Thiobacillus) и нитчатым бактериям (род Leptothrix). Бактерии, отнесенные к порядку железобактерий, разделены на 2 семейства. Многие представители этих семейств обладают своеобразной морфологией и сложным жизненным циклом.
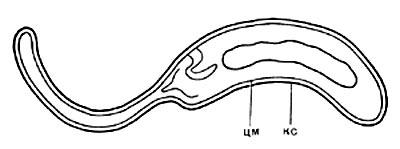
Рис. 70. Схема строения типичной клетки стебельковой бактерии. КС — клеточная стенка, ЦМ — цитоплазматическая мембрана
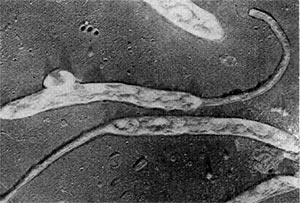 Рис. 71. Типичные клетки бактерий рода Caulobacter. Электронная микрофотография. Увел. X 20 000.
Рис. 71. Типичные клетки бактерий рода Caulobacter. Электронная микрофотография. Увел. X 20 000.Семейство железобактерии (FERRIBACTERIACEAE)
Клетки представителей семейства обладают либо ложными слизистыми придатками, либо истинными стебельками — выростами цитоплазмы. Они широко распространены в природе, и прежде всего в иле и воде пресных водоемов. Семейство представлено 6 родами.
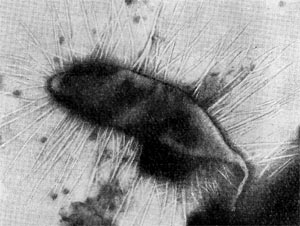 Рис. 72. Стебельковая бактерия с нетипичным тонким стебельком. Увел. X 25 000.
Рис. 72. Стебельковая бактерия с нетипичным тонким стебельком. Увел. X 25 000.Роды галлионелла и невския (Gallionella и Nevskia)
Бактерии, принадлежащие к родам Gallionella и Nevskia (рис. 69), обладают придатками, состоящими из слизи и не связанными с цитоплазмой клетки. Форма и размеры таких придатков сильно варьируют. При исследованиях природных субстратов у бактерий из рода Gallionella легко обнаруживаются почковидные или палочковидные клетки, которые формируют длинные перевитые слизистые стебельки, пропитанные окислами железа. Согласно представлениям, развиваемым Г. А. Заварзиным, природа стебельков Gallionella иная. Стебельки представляют собой скопление живых организмов, не обладающих клеточной стенкой и способных формировать длинные нити. Эти организмы паразитируют на клетках истинных бактерий. Поэтому то, что принималось обычно за бобовидную клетку Gallionella, является лишь клеткой-хозяином, который может быть в разных случаях разным. Такими паразитами могут быть прежде всего микоплазмы, которые будут рассмотрены в соответствующем разделе. Истинные стебельковые бактерии имеют стебелек, сформированный клеточной стенкой и цитоплазматической мембраной. Они отнесены к семейству Caulobacteriaceae.
Семейство сидерокапсы (SIDEROCAPSACEAE)
Все организмы, объединенные в семействе Siderocapsaceae, сходны между собой, являясь, по-видимому, разными экологическими формами одной или нескольких близких бактерий. Известны успешные попытки и описания указанных микроорганизмов в составе одного рода. В это семейство входят палочковидные или кокковидные (часто овальные клетки) неспоро-образующие гетеротрофные бактерии, образующие слизистую капсулу, пропитанную солями железа или марганца. Бактерии, принадлежащие к роду Siderocapsa, имеют небольшие клетки (1 — 2 мкм в диаметре), объединенные в первичные капсулы (по 2—60 и более клеток). Эти капсулы с клетками (общий диаметр 10—20 мкм) объединяются в более сложные агрегаты, где и откладывается железо или марганец. Род Sideromonas объединяет палочковидные бактерии (длина клетки 2 мкм), имеющие капсулы и формирующие группы (пары, цепочки) и скопления. К семейству Siderocapsa-сеае были отнесены описанные в разное время микроорганизмы: род Siderosphaera (объединены по 2 клетки в капсуле), род Sideronema (крупные палочки диаметром 5,0—6,5 мкм, соединенные в цепочки и заключенные в капсулы). Три известных в литературе рода — Naumaniella, Ochrobium, Siderococcus — объединяют, подобные описанным выше, мелкие (диаметр клетки 2 мкм) палочки, не обладающие капсулами. Отложение окислов железа и марганца происходит прямо на клетках.Стебельковые бактерии
Стебельковые бактерии в настоящее время рассматриваются как группа организмов, близкая к эубактериям, и выделяются в семейство кауло-бактерии (Caulobacteriaceae). Принадлежность к определенному порядку не уточнена.
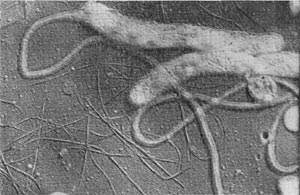 Рис. 73. Клетки стебельковой бактерии пз рода Asticcacaulis. Электронная микрофотография. Увел. X 20 000.
Рис. 73. Клетки стебельковой бактерии пз рода Asticcacaulis. Электронная микрофотография. Увел. X 20 000.Род каулобактер (Caulobacter)
Большинство истинных стебельковых бактерий относятся к этому роду. Похожие на псевдомонады клетки, с одним полярно расположенным жгутиком, прикрепляются тем концом, на котором находится жгутик, к какой-либо поверхности (часто к другой клетке) и формируют стебелек. Стебелек имеет довольно сложное строение. Наружная поверхность образована клеточной стенкой, за которой следует цитоплазматическая мембрана, т. е. стебелек является выростом (выпячиванием) клетки, сохраняющим ее внутреннюю структуру (рис. 70, 71). Внутри стебелька находится много мембранных структур, играющих важную роль в жизнедеятельности клетки. Форма и размеры стебельков сильно варьируют. Встречаются бактерии с очень тонкими стебельками (рис. 72), и даже у одного и того же вида бактерии в зависимости от условий среды могут быть очень длинные (5 —10 мкм и более) изогнутые стебельки и короткие, едва заметные. В почве нередко можно обнаружить клетки стебельковых бактерий, усеянные по всему периметру, включая стебелек, выростами клеточной стенки — фимбриями (рис. 72).
Функции фимбрий у стебельковых бактерий неясны
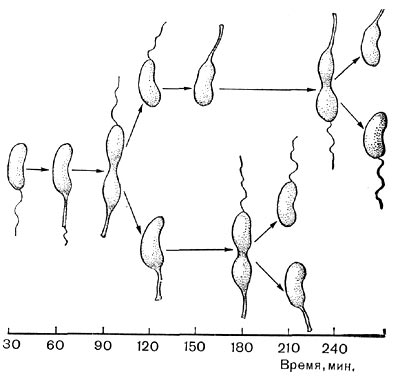 Рис. 74. Стадии жизненного цикла Caulobacter. Схема (по Броку, 1970).
Рис. 74. Стадии жизненного цикла Caulobacter. Схема (по Броку, 1970).
Род стебельковых бактерий — астикакаулис (Asticcacaulis)
Другой род стебельковых бактерий — астикакаулис (Asticcacaulis) — объединяет бактерии, отличающиеся от описанных лишь асимметричным расположением стебелька (рис. 73). Представители этого рода широко распространены в воде пресных и соленых водоемов. Встречаются в почвах. Клетки стебельковых бактерий размножаются поперечным делением, причем дочерняя клетка несет жгутик, но не обладает стебельком, который формируется позже, продолжая нести на дистальном конце жгутик. Это придает большое своеобразие циклу развития этих бактерий, что хорошо видно из схемы (рис. 74).Следует отметить, что на конце стебелька часто образуется небольшая слизистая подушечка, обеспечивающая плотное прикрепление к поверхностям. Отмечены случаи прикрепления стебельковых бактерий к живым клеткам других бактерий, что породило предположения об их паразитизме, оказавшиеся неверными. Стебельковые бактерии выступают здесь в роли эпибионтов — организмов, поселяющихся на других организмах или рядом, но не связанных симбиотическими или иными взаимоотношениями.
Стебельковые бактерии — типичные обитатели пресных водоемов, илов и почв. Будучи гетеротрофами, они развиваются в природе при низких концентрациях органических веществ. В лабораторных условиях их почти всегда можно обнаружить в виде пленки даже на поверхности дистиллированной воды. В этих условиях они развиваются, используя растворяющиеся в воде питательные вещества, поступающие из воздуха. Вполне вероятно, что они способны также усваивать летучие органические соединения, содержащиеся в воздухе. Сведения о возможности воздушного питания бактерий были получены несколько десятков лет назад видным советским ученым Н. Г. Холодным. Эти бактерии в большей мере, чем другие гетеротрофы, обладают способностью к гетеротрофной фиксации углекислоты из воздуха, т. е. включением С02 в клетку непосредственно без энергетических затрат за счет фотосинтеза или энергии, получаемой при превращении неорганических веществ.
Роль стебельковых бактерий в природе определяется их физиологическими особенностями как гетеротрофных микроорганизмов, способных развиваться в зонах обеднения, где неактивны более требовательные к пище сапрофиты.
Порядок почкующиеся бактерии (HYPHOMICROBIALES)
К порядку почкующихся бактерий (Hypho-microbiales) относятся гетеротрофные грамотрицательные неспорообразующие бактерии со своеобразной морфологией. Их характерной особенностью является наличие гиф — выростов, образованных клеточной стенкой и цито-плазматической мембраной, и размножение путем образования почек на гифах. Многие виды способны аккумулировать окислы железа и марганца. Водные почкующиеся бактерии часто встречаются в больших количествах в олиготрофных озерах и нередко в почвах при сильном увлажнении. Рост почкующихся бактерий задерживается даже при небольших концентрациях аминокислот и углеводов. Тем не менее они малочувствительны к повышенным концентрациям нитритов и минеральных солей. В порядок входит семейство Hyphomicrobiaceae.
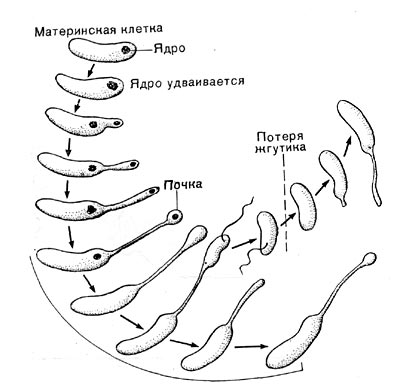 Рис. 75. Стадии жизненного цикла Hyphomicrobium. Схема (по Броку, 1970).
Рис. 75. Стадии жизненного цикла Hyphomicrobium. Схема (по Броку, 1970).Род гифомикробиум (Hyphomicrobium)
Представители этого рода имеют вид вытянутых палочек (0,5 X 2 мкм), от одного из полюсов которых отходит гифа. Весьма своеобразным оказывается цикл развития этих организмов. Вначале материнская клетка, прикрепленная к субстрату, образует тонкий вырост, который удлиняется, формируя гифоподобную структуру. На конце гифы образуется почка. Почка разрастается, и формируется жгутик. Затем дочерняя клетка отделяется от материнской и уплывает. Потеряв жгутик и завершив созревание, дочерняя клетка формирует гифу и почку. Почки могут образоваться вновь на материнской клетке. Возможны разные варианты такого цикла (рис. 75). В некоторых случаях дочерние клетки не отделяются от материнских и образуют гифы и почки на другом полюсе клетки. Возникает сложное скопление гиф и клеток. Иногда почки образуются на материнской клетке без гиф. В других случаях гифы возникают на обоих полюсах клетки (рис. 76). В отличие от стебельковых бактерий прикрепительный матеррил образуется у почкующихся бактерий на полюсе, обратном по отношению к гифе. При этом нередко образуются упорядоченные скопления клеток — розетки.
Следует отметить, что размножение почкующихся бактерий начинается делением ядра. Одно из ядер по гифе переходит в почку, которая, достигнув величины клетки, отделяется. Почкующиеся бактерии сильно изменчивы и в зависимости от условий среды меняют морфологию. Развитие часто бывает усложненным. Одни виды развиваются по типу других. Часто образуются сидячие (долго растущие) почки. Последовательность роста гифы и почек случайна (рис. 77).
Род педомикробиум (Pedomicrobium)
К этому роду почкующихся бактерий, описанному Т. В. Аристовской (1961), относят микро-аэрофильные бактерии, аккумулирующие железо и марганец. Они имеют вид крупных овальных, реже палочковидных клеток, образующих от одной до четырех ветвящихся нитей. Эти нити, как правило, заканчиваются почками, которые представляют собой дочерний организм. Некоторые виды (Pedomicrobium podso-licum) обладают мелкими клетками (диаметр 0,5—1,5 мкм), соединяющие их нити чрезвычайно тонки. Иногда нити сильно редуцированы, и в результате почкования образуются грозди кокков разного размера. В лабораторных условиях не удается выделить культуры этих бактерий в чистом виде, а в случае успешного выделения некоторых штаммов культура погибает.
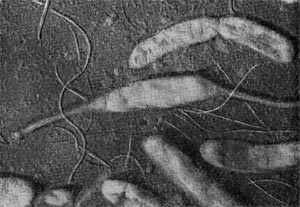 Рис. 76. Клетка Hyphomicrobium с двумя стебельками. Электронная микрофотография. Увел. X 20 000.
Рис. 76. Клетка Hyphomicrobium с двумя стебельками. Электронная микрофотография. Увел. X 20 000.Род анкаломикробиум (Ancalomicrobium). Сюда относятся одноклеточные бактерии, имеющие от 2 до 8 отростков длиной до 3 мкм, отходящих от клеток. Отростки могут раздваиваться, но сами не почкуются (рис. 78—80). Почки образуются на клетке. Клетки неподвижны, ведут прикрепленный образ жизни.
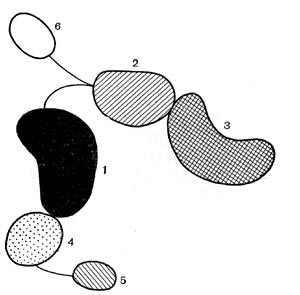 Рис. 77. Последовательность роста гиф и почек Hyphomicrobium. (Цифры означают поэтапность перехода к росту разных участков гнф и почек.) Схема.
Рис. 77. Последовательность роста гиф и почек Hyphomicrobium. (Цифры означают поэтапность перехода к росту разных участков гнф и почек.) Схема.Род простекомикробиум (Prosthecomicrobium)
Микроорганизмы, относящиеся к этому роду, сходны с представителями рода Prosthecomicrobium, но с более короткими (1 мкм) отростками, отходящими от клетки в стороны (рис. 81, 82). Клетки делятся двойной перетяжкой. Молодые клетки могут передвигаться, имея полярный жгутик. Взрослые клетки обладают способностью прикрепляться к субстрату. Имеются пигментированные виды. Представители обоих описанных выше родов широко распространены в воде, илах и во многих почвах. Подобно стебельковым бактериям, они являются типичными представителями экологической группы олиготрофных бактерий.
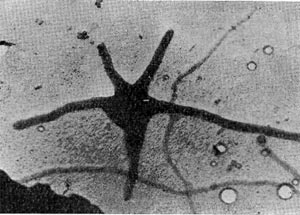 Рис. 78. Клетка с гифами (простеками), близкая по морфологии к организмам из рода Ancalomicrobium. Электронная микрофотография. Увел. X 20 000.
Рис. 78. Клетка с гифами (простеками), близкая по морфологии к организмам из рода Ancalomicrobium. Электронная микрофотография. Увел. X 20 000.Другие представители почкующихся бактерий
К почкующимся бактериям относят также ряд других организмов.
Род бластобактер (Blastobacter)
Род бластобактер (Blastobacter) представлен видами, наблюдавшимися в воде пресных водоемов. Обычно слегка изогнутые клиновидные клетки собраны в плотные розетки. На свободных концах клеток образуются почки.
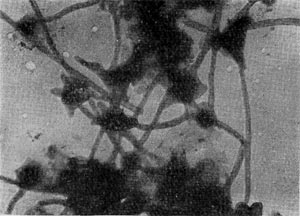 Рис. 79. Скопление клеток из рода Ancalomicrobium Суспензия почвы в электронном микроскопе. Увел. X 15 000.
Рис. 79. Скопление клеток из рода Ancalomicrobium Суспензия почвы в электронном микроскопе. Увел. X 15 000.Давно известный микроорганизм, обнаруженный еще С. Н. Виноградским более полувека назад, — нитробактер (Nitrobacter) — был впоследствии отнесен к почкующимся бактериям. Нитробактер способен окислять нитрит до нитрата, играя большую роль в круговороте азота в природе. К почкующимся бактериям относят и ряд своеобразных микробов, обнаруженных впервые Б. В. Перфильевым при исследовании пресных озер. Это гетеротрофные микроорганизмы, аккумулирующие в колониях железо и марганец: металлогениум (Metallogenium), кузнецовиа (Kuznezovia). Эти организмы, по-видимому, ответственны за образование озерных руд. Типичная стадия развития Metallogenium — микроколония, в форме паучка, составлена радиально расходящимися нитями, покрытыми окислениями марганца. После растворения окислов марганца удается часто обнаружить мелкие почкующиеся клетки, связанные плазматическими нитями. На нити вырастает короткая ножка, на которой образуется почка. Почка прорастает и вновь возникает паукообразная микроколония.
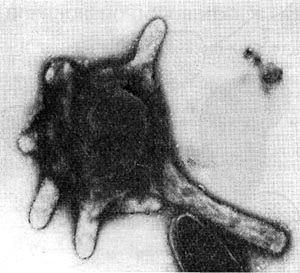 Рис. 80. Молодая клетка Ancalomicrobium. Электронная микрофотография. Увел. X 30 000.
Рис. 80. Молодая клетка Ancalomicrobium. Электронная микрофотография. Увел. X 30 000.Микроколонии организмов из рода Kuznezovia несколько иные, чем у Metallogenium, но по природе эти организмы сходны. За последние годы проведены расследования, позволившие предположить иную природу Metallogenium, Kuznezovia и других подобных организмов. Получены доказательства в пользу того, что эти организмы являются сапрофитными микоплазмами (см. стр. 311). Возможно также, что они паразитируют на других организмах (грибах). При росте на специфических для микоплазм средах можно видеть образование большого числа очень мелких телец, которые проходят через бактериальные фильтры и на средах для Metallogenium дают три-хосферический рост (паучки) с осаждением окислов марганца возле микроколонии. Аккумуляция марганца, естественно, не имеет ничего общего с автотрофией и является следствием тех же процессов, которые были описаны для некоторых неспороносных бактерий. Имеются и другие мнения, что свидетельствует о незавершенности исследований по выяснению природы Metallogenium.
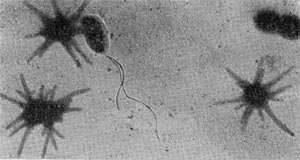 Рис. 82. Клетка неизвестного микроорганизма, напоминающего Prosthecomicrobium. Увел. X 25 000.
Рис. 82. Клетка неизвестного микроорганизма, напоминающего Prosthecomicrobium. Увел. X 25 000.Лучистые грибки. Порядки актиномицеты (ACT1NOMYCETALES)и актинопланы(ACTINOPLANALES)
Лучистые грибки известны под общим названием Actinomyces — актиномицеты. Они давно привлекают внимание специалистов различных областей микробиологической науки. Еще не так давно работы, посвященные этой группе микроорганизмов, выполнялись преимущественно медиками. Чрезвычайно широкое распространение акти-номицетов в природе дает основание полагать, что этим организмам принадлежит большая роль в круговороте веществ, как органических, так и минеральных. Среди актиномицетов имеются аэробы и анаэробы, мезофилы и термофилы. Актиномицеты преимущественно сапрофиты, но среди них есть и паразиты, приносящие вред людям, животным и растениям. К классу Actinomycetes, кроме типичных актиномицетов, относятся проактиномицеты, микобактерии и микококки. Для всех этих организмов характерно ветвление клеток. Проактиномицеты отличаются от актиномицетов тем, что имеют мицелий только в ранней стадии развития. Молодые нити мицелия вскоре распадаются на палочки и кокки. Проактиномицеты образуют колонии тестообразной консистенции, голые или покрытые налетом воздушного мицелия. Микобактерии можно рассматривать как промежуточную форму между актиномицетами и эубактериями. У микобактерии нет настоящего мицелия, в отдельных случаях наблюдаются нитевидные элементы. Палочковидные клетки микобактерии имеют неправильные очертания, контуры их неровные. В отличие от истинных бактерий клетки микобактерии способны ветвиться. В работах, посвященных бактериям, микококки рассматриваются как генетически однородная группа. Внешне микококки похожи на микрококки. Иногда микококки образуют палочковидные клетки с ветками.
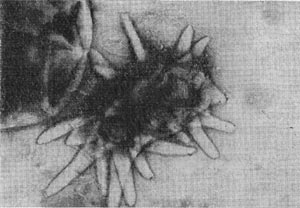 Рис. 82. Клетка неизвестного микроорганизма, напоминающего Prosthecomicrobium. Увел. X 25 000.
Рис. 82. Клетка неизвестного микроорганизма, напоминающего Prosthecomicrobium. Увел. X 25 000.В последние годы лучистые грибки приобрели большое практическое значение в связи с их способностью продуцировать различные физиологически активные вещества, используемые человеком. Из многих культур актиномицетов получают лекарственные препараты — антибиотики, используемые в медицине, ветеринарии, растениеводстве, пищевой промышленности. Актиномицеты способны продуцировать витамины, гормоны, ферменты, токсины, ростовые вещества, аминокислоты и другие полезные для человека биологические вещества. Важную роль актиномицеты играют в процессах почвообразования и формировании плодородия почв. Им приписывают различные функции в оздоровлении почв.
Для того чтобы правильно распознать и определить лучистые грибки, чтобы выявить нужные биологические вещества, вырабатываемые ими, необходимо знать точную характеристику этой группы микроорганизмов. Первые сведения об актиномицетах появились в 1874 г., когда немецкий ученый Ф. Кон выделил и описал микроб с тонкими ветвящимися нитями. В 1878 г. Ц. Гарц обнаружил нитевидные сплетения с лучистым расположением нитей. Найденный микроорганизм был назван им лучистым грибком — Actinomyces.
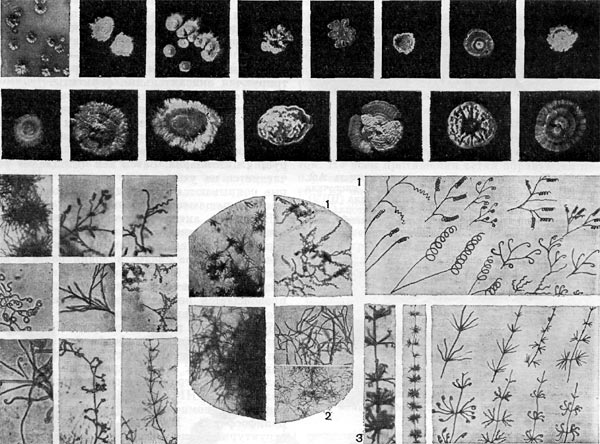 Рис. 83. Вверху — форма колоний актиномицетов на поверхности плотных питательных сред. Внизу - типы спороносцев: 1 — спиральные; 2 — прямые; 3 — мутовчатые; 4 — примитивные.
Рис. 83. Вверху — форма колоний актиномицетов на поверхности плотных питательных сред. Внизу - типы спороносцев: 1 — спиральные; 2 — прямые; 3 — мутовчатые; 4 — примитивные.Первые сведения о строении актиномицетов относятся к началу XX века. Исследования этого периода были сосредоточены главным образом на болезнетворных (патогенных) формах актиномицетов как возбудителях заболеваний человека и животных, вызывающих актиномикозы. В 1921 г. немецкий исследователь Р. Лиске обобщил все накопленные за 50 лет данные о происхождении и свойствах актиномицетов, а также на основании собственных наблюдений описал морфологию различных видов актиномицетов. С 1930 г. исследования актиномицетов проводил Н. А. Кр асильников, который всесторонне изучил эту группу организмов.
Огромное значение имеют работы С. Ваксмана, который вместе с А. Шатцем в 1945 г. выделил из культуры актиномицета антибиотик стрептомицин, нашедший широкое применение в медицине. Это открытие послужило толчком к интенсивному исследованию этой группы микробов и поискам продуцируемых ими новых веществ.
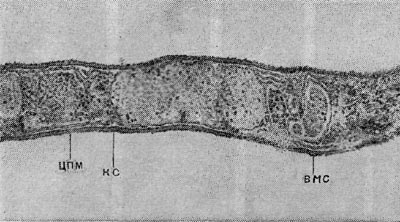 Рис. 84. Ультраструктура клеток актиномицета Act. streptomycini. Окружает клетку плотная клеточная стенка (КС), за ней идет трехслойная мембрана (ЦПМ). Центральная часть клетки заполнена цитоплазмой, в которой хорошо видны рибосомы и мембранные структуры (ВМС). Увел. X 30 000.
Рис. 84. Ультраструктура клеток актиномицета Act. streptomycini. Окружает клетку плотная клеточная стенка (КС), за ней идет трехслойная мембрана (ЦПМ). Центральная часть клетки заполнена цитоплазмой, в которой хорошо видны рибосомы и мембранные структуры (ВМС). Увел. X 30 000.За последнее время выявлены и изучены многие тысячи представителей класса Actinomycetes. Описаны новые формы, которые способны вырабатывать полезные для человека вещества. Была создана антибиотическая промышленность. Лучистые грибки различаются между собой по своему строению и развитию клеток, морфологически, физиологически, культурально, биохимически. Среди них есть организмы со сложным строением плодоносных органов и организмы весьма упрощенного строения. По этому признаку актиномицеты разделяются на две группы — высшие и низшие формы. К высшим относятся организмы с хорошо развитым мицелием и обладающие особыми органами плодоношения, при помощи которых актиномицеты размножаются. В эту группу входит большинство основных семейств и родов, составляющих класс Actinomycetes. К низшим формам относятся организмы, не образующие мицелия и имеющие палочковидные и кокко-видные клетки.
 Рис. 85. Фрагментационный способ образования спор.
Рис. 85. Фрагментационный способ образования спор.Строение лучистых грибков
Все высшие формы лучистых грибков имеют хорошо развитый мицелий. Толщина гиф мицелия варьирует в широких пределах в зависимости от видовой принадлежности культуры, ее возраста, условий развития. Диаметр тонких гиф 0,1 —1,0 мкм, наиболее толстых гиф — до 1,5 мкм. У актиномицетов, выращенных на плотных агаризованных средах (поверхностные культуры), различают три типа мицелия: субстратный, воздушный и надсубстратный, или колонии. Субстратный мицелий развивается в глубине среды и представляет собой как бы корневую питательную систему. Нити его всасывают питательные вещества среды и доставляют колонии, а оттуда в воздушный мицелий. Мицелий надсубстратный развивается на поверхности агаризованной среды, разрастается плотным сплетением в колонии большей или меньшей величины. На рисунке 83 показаны некоторые типы колоний актиномицетов. Колонии лучистых грибков плотные, кожистые, крепко срастающиеся со средой. Величина их зависит от вида актиномицетов и условий их роста, они могут быть мелкими — 0,5—2 мм и крупными — до I см и более. Внешний вид колоний также различен: колонии бывают с гладкой, бугристой, складчатой и зернистой поверхностью. Воздушный мицелий актиномицетов формируется на поверхности колонии. Нити его отходят от мицелия колонии, разрастаются в густую пушистую, бархатистую или мучнистую массу. Нередко воздушный мицелий развивается слабо в виде небольшого налета, а некоторые организмы и вовсе лишены его.
 Рис. 86. Сегментацпонный способ образования спор.
Рис. 86. Сегментацпонный способ образования спор.Исследованиями последних лет было показано, что поверхность клеток воздушного мицелия отличается от поверхности субстратного мицелия. На поверхности клеток воздушного мицелия обнаружен рыхло связанный слой, построенный из очень тонких нитевидных частиц и различных фибриллярных телец. Субстратный мицелий называют первичным, а воздушный — вторичным. Есть сообщения и о том, что способность образования воздушного мицелия у актиномицетов может быть стимулирована или подавлена при добавлении в питательную среду определенных веществ.
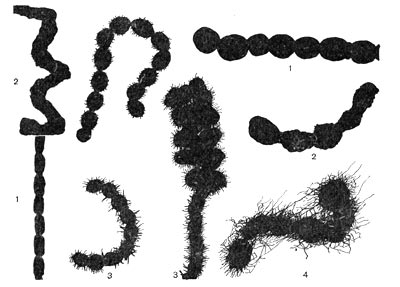 Рис. 87. Поверхность оболочки спор у актиномицетов: 1 — гладкая; 2 — бугристая; 3 — шиповидная; 4 — волосистая.
Рис. 87. Поверхность оболочки спор у актиномицетов: 1 — гладкая; 2 — бугристая; 3 — шиповидная; 4 — волосистая.Исследователи наблюдали случаи, когда естественная потеря способности формировать воздушный мицелий у некоторых актиномицетов восстанавливается при добавке в питательную среду витаминов (биотин), аминокислот (метио-нин) и других веществ.
Клетки актиномицетов состоят из нескольких основных частей. На рисунке 84 показан общий план строения клетки актиномицетов. Клетка ограничена оболочкой — стенкой, толщина которой от 0,01 до 0,03 мкм. На поверхности оболочек мицелия расположена слизистая капсула. Обычно она очень тонкая и не обнаруживается при микроскопическом анализе, но у отдельных представителей лучистых грибков наблюдается обильное, видимое простым глазом скопление слизи, которое является специфическим признаком определенных групп организмов.
Оболочка актиномицетов в целом представляет собой относительно неплотную систему. Через нее в клетку могут проникать многие химические соединения, например белок, антибиотики, аминокислоты и многие другие вещества.
Оболочка принимает участие в общем обмене веществ и образовании различных продуктов жизнедеятельности клетки — метаболитов. Оболочка построена так же, как и у грамположи-тельных бактерий, и состоит из белковых, ли-пидных, мукополисахаридных' компонентов. У отдельных групп актиномицетов в оболочках содержатся фосфорные соединения, тейхоевые кислоты, количество которых у разных представителей актиномицетов не одинаковое.
Многие исследователи пытаются подразделить организмы на группы в зависимости от химического состава оболочек. Так, американские микробиологи лучистые грибки делят на 6 групп в зависимости от содержания в оболочках разных стереоизомеров диаминопимелино-вой кислоты (ДАП), аминокислот и Сахаров. Другие ученые считают, что пока нет достаточных экспериментальных сведений, которые позволили бы делить организмы на соответствующие группы по химическому составу их оболочек. Состав оболочек, по-видимому, не может служить единственным критерием для разделения актиномицетов, так как у одной и той же группы культур в оболочках находят различные по составу компоненты.
Под оболочкой у актиномицетов, как и у всех других микроорганизмов, находится цитоплаз-матическая мембрана. Мембрана актиномицетов принимает участие в процессах обмена веществ, а также при делении клеток. Рост мембраны приводит к впячиванию ее внутрь клеток, в результате чего образуется поперечная перегородка. Исследования японских специалистов и других авторов показали, что цито-плазматическая мембрана принимает участие и в образовании спор.
Цитоплазма клетки состоит из оптически плотных скоплений различных размеров, рисунка и сложности. В цитоплазме имеется также нуклеоид, заполненный сетью переплетенных нитей ядерного вещества. Ядерное вещество не имеет мембраны и не отделено от цитоплазмы. В старых культурах цитоплазма мицелия приобретает грубозернистую структуру, распадается на отдельные комочки. Нити одной и той же культуры не равноценны по состоянию цитоплазмы и составу оболочки. В цитоплазме актиномицетов обнаружены растворимые и нерастворимые полифосфаты, полисахариды, а у отдельных культур — жировые вещества. При ультрамикроскопическом анализе клеток лучистых грибков в цитоплазме выявляются особые структуры мезосомы с тонким мембранным строением. Наблюдается связь этих структур с цитоплазматической мембраной. Эти мембранные тельца расположены или беспорядочно, или в виде концентрических колец, рыхлые либо плотно сжатые, в одних клетках их больше, в других — меньше. Во внутрицитоплазматических мембранах концентрируются окислительные ферменты.
При спорообразовании в клетках наблюдаются следующие изменения: хроматиновое вещество разделяется на комочки различной формы и величины, располагающиеся вдоль спороносной гифы, вокруг них концентрируется цитоплазма. Затем вся цитоплазма расчленяется на участки — проспоры, которые покрываются собственной оболочкой и затем превращаются в споры.
В нитях актиномицетов, кроме хроматиновых зерен, имеются гранулы волютина, который образуется и накапливается в зависимости от состава среды, условий роста и возраста культур. Появление волютиновых гранул в цитоплазме клеток актиномицетов сопровождается резким снижением антибиотической продуктивности мицелия.
Волютиновые гранулы содержат РНК и кислотонерастворимые полифосфаты. Причем состав волютина гиф разного возраста неодинаков: на ранних стадиях развития культур в волютиновых гранулах содержится большее количество РНК, на более поздних стадиях основными компонентами волютина являются полифосфаты. Волютин — не обязательный структурный элемент клеток актиномицетов. Волютиновые гранулы появляются обычно на более поздних стадиях развития культуры в условиях нарушенного баланса между отдельными компонентами питательной среды. При культивировании актиномицетов на некоторых средах (особенно при глубинном выращивании) в цитоплазме гиф появляются вакуоли в виде маленьких или крупных пузырьков. Содержимое вакуолей в молодых гифах однородное. В зрелых нитях мицелия встречаются крупные зернистые вакуоли. Предполагается, что эти вакуоли образуются из запасных веществ. Клетки мицелия представителей лучистых грибков хорошо окрашиваются основными анилиновыми красками: метиленовой синью, метиловым фиолетовым, карболовым фуксином и др.
Характерной особенностью всех лучистых грибков является их способность окрашиваться по Граму положительно. Клетки лучистых грибков устойчивы к щелочным условиям среды и действию протеолитических ферментов (трипсина, пепсина). Грамположительные формы микробов более чувствительны к действию антибиотиков, чем грамотрицательные, и менее чувствительны к реактивам: анилину, фенолу, этиловому спирту, бензолу, хлороформу и др.
У разных представителей лучистых грибков способы размножения различны. Актиномицеты имеют специальные спороносные органы - спороносцы, или спорангии. Спороносцы у актиномицетов различаются по своему строению и расположению: прямые, длинные или короткие, волнистые; спирально закрученные; число завитков от 1 до 10 и более. Завиток может быть растянутым или плотно сжатым. Расположение спороносных веток моноподиальное (последовательное), мутовчатое и пучкообразное, супротивное. В мутовках спороносные ветки могут быть прямыми и спиральными. На рисунке 83 показаны основные типы строения спороносцев актиномицетов.
Для актиномицетов характерно образование спор — конидий. Споры формируются на воздушном мицелии, в отдельных случаях — на субстратном мицелии. Отмечено два типа образования спор — фрагментационное и сегментационное.
Фрагментационный процесс характеризуется тем, что вокруг ядерных элементов, равномерно распределенных по гифе, концентрируется цитоплазма, которая покрывается собственной оболочкой и превращается в зрелую спору. Оболочка спороносных нитей некоторое время сохраняется, затем распадается, споры высыпаются и в соответствующих условиях снова прорастают, образуя гифы новых колоний актиномицетов (рис. 85). При сегментационном образовании спор наблюдается простое деление спороносных клеток. На всем протяжении ветки образуются поперечные перегородки,и спороносец расчленяется на ряд равномерных клеток — спор. Перед сегментацией в спороносящей ветке происходит деление ядерного вещества, образуется столько зерен хроматина, сколько будет спор. Вокруг хроматиновых зерен также концентрируется плазма клетки. Когда споры созревают, спороносец распадается на отдельные споры (рис. 86).
Споры актиномицетов различаются по форме. Они бывают шаровидными, цилиндрическими, палочковидными, грушевидными. У одних видов актиномицетов поверхность оболочки спор имеет шиловидную, бугристую, волосовидную структуры, у других — поверхность оболочки гладкая (рис. 87). Этот признак используется для определения принадлежности актиномицетов к той или иной группе.
По сравнению с вегетативными клетками споры обладают повышенной устойчивостью к действию неблагоприятных факторов. Так, культуры актиномицетов, высушенные до воздушно-сухого состояния, могут сохранять жизнеспособность в течение нескольких лет. Споры устойчивы и к механическому воздействию: при растирании культур в смеси с частицами песка споры не теряют жизнеспособности, тогда как соответствующие им по размеру фрагменты вегетативного мицелия погибают. Имеются сведения, что споры актиномицетов могут свободно переноситься по воздуху. Прорастание спор у лучистых грибков однотипное. На свежей питательной среде они сначала несколько разбухают, затем на поверхности появляются бугорки — почки, которые, удлиняясь, прорастают в длинные нити. Нити ветвятся, формируя мицелий — колонии лучистых грибков.
Актиномицеты могут размножаться также обрывками мицелия разной длины, от едва заметного комочка до палочковидных элементов. Культуры актиномицетов пересеваются с помощью комочков субстратного или воздушного мицелия или самой колонии. Во всех случаях вырастают нормальные клетки дочернего организма, свойственные данному виду.
Группы лучистых грибков отличаются по способу образования органов плодоношения, что служит признаком для деления их на семейства, роды.
Классификация лучистых грибков
Для систематики актиномицетов были использованы основные признаки, которыми характеризуются представители этой группы микробов. При этом учитывались данные изучения экспериментальной морфологической изменчивости различных групп антиномицетов, строение и развитие органов плодоношения, характер спороносцев, строение оболочки спор. По этим признакам лучистые грибки разбиваются на крупные таксоны. Дальнейшая дифференциация на виды основана главным образом на физиолого-биохимических свойствах лучистых грибков.
При определении видов актиномицетов учитывают их способность образовывать красящее вещество (пигменты), расти на питательных средах с определенным набором веществ, образовывать специфические вещества, как-то: антибиотики, ферменты, токсины и др. Выращивая организмы в одних и тех же условиях, можно легко выявить различия между ними, морфологическое, культуральное, физиологическое и биохимическое сходство. На рисунке 88 приведена схема классификации лучистых грибков (высшие формы). Класс Actinomycetes состоит из двух порядков. Actinoplanales — подвижные и Actinomycetales — неподвижные формы. Класс объединяет 6 семейств, в которые входят 26 родов. В таблице схематично показано, как образуются в каждом семействе, роде органы плодоношения — спорангии, споры — и чем они отличаются друг от друга.
Семейства актиномицеты (ACTINOMYCETACEAE), МИКРОМОНОСПОРОВЫЕ (MICROMONOSPORACEAE) И СТРЕПТОСПОРАНГИЕВЫЕ (STREPTOSPORANGIACEAE)
У микроорганизмов рода Actinomyces, входящих в семейство Actinomycetaceae, образование спор происходит на прямых или спирально закрученных ветках — спороносцах воздушного мицелия. Споры формируются одновременно на всем протяжении спороносца; образуются длинные цепочки, в которых содержится от 30 до 50 спор. Эта группа организмов наиболее распространенная. Характерной особенностью рода актинопикнидиум (Actinopycnidium), описанного в 1962 году, является наличие плодовых тел типа п и к н и д. Формируются они при сплетении нитей мицелия. Наружные нити мицелия образуют сплошную оболочку. Гифы внутри пикнид распадаются на короткие элементы, из которых формируются пикнидо-спо-ры. Когда оболочка пикнид разрушается, споры высыпаются наружу.
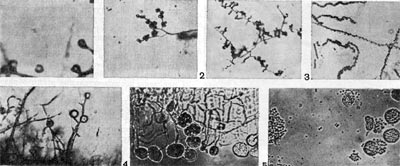 Рис. 89. Рост культур из семейств Micromonosporaceae и Streptosporangiaceae: 1 — культуры рода Micromonospora; 2 — культуры из рода Microbispora; 3 — культуры из рода Micropolyspora; 4 — формирование спорангиев у культур из рода Streptosporangium; 5 — зрелые спорангии и выход из них спор у Streptosporangium.
Рис. 89. Рост культур из семейств Micromonosporaceae и Streptosporangiaceae: 1 — культуры рода Micromonospora; 2 — культуры из рода Microbispora; 3 — культуры из рода Micropolyspora; 4 — формирование спорангиев у культур из рода Streptosporangium; 5 — зрелые спорангии и выход из них спор у Streptosporangium.Типичным признаком представителей рода чайниа (Chainia) является способность образовывать особые плодовые тела — склероции, внутри которых спор нет. Размножаются эти организмы спорами, которые формируются на спиральных или неспиральных спороносцах. Организмы из рода проактиномицес (Ргоactinomyces) размножаются оидиоспорами, которые формируются путем сегментации на коротких спороносцах. Мицелий этих организмов часто распадается на палочковидные и кокковидные формы. По характеру строения и развития мицелия род проактиномицетов разделяется на 2 типа —актиноидный и проак-тиномицетный. У актиноидного типа культур образуется воздушный мицелий, ветки которого имеют спороносцы. Мицелий расчленяется на нити и палочки. У культур проактиномицетного типа мицелий существует короткое время, он быстро расчленяется на короткие палочки и кокковидные клетки.
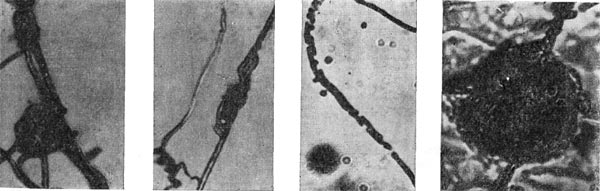 Рис. 90—91. Гифы и спорангии у культур из рода Actinosporangium.
Рис. 90—91. Гифы и спорангии у культур из рода Actinosporangium.Все семейство микромоноспоровых (Micromonosporaceae) характеризуется общим признаком — способностью формировать споры на коротких спороносцах: по одной споре - род микромоноспора (Micromonospora); по две — род микробиспора (Microbispora); по нескольку спор — род микрополиспора (Micropolyspora, рис. 89, 1, 2, 3). Род актинобифида (Actinobifida) характеризуется дихотомическим ветвлением спороносных веток. На конце спороносца формируется одна спора. Организмы рода промикромоноспора (Promicromonospo-га) характеризуются тем же строением и развитием, что и микроорганизмы рода Proactino-myces, входящего в семейство Actinomycetaceae, прежде всего распадающимся мицелием, но плодоношение у этих организмов другое, как у семейства микромоноспоровых, — на коротких ветках мицелия формируются одиночные споры — конидии. Представителям семейства стрептоспорангиевых (Streptosporangiaceae) свойственно образование плодовых тел — спорангиев, в которых формируются споры. Способы образования спорангиев различны. У рода стрептоспорангиум (Streptosporangium) (рис. 89, 4,5) формирование спорангиев происходит путем спирального закручивания спороносящих веток, образуются шаровидные клубочки, покрытые общей оболочкой. Внутри этих клубочков нити расчленяются на короткие клетки — споры. При прорастании спор образуются 1—3 выроста, которые удлиняются, образуя мицелий. У представителей рода актиноспорангиум (Actinosporangium) споры формируются в скоплениях слизистой бесформенной массы типа спорангиев, но без оболочки. На рисунках 90 — 91 показаны последовательные этапы образования слизистых спорангиев у культур этого рода. При обильном образовании спорангиев колонии приобретают черную окраску.
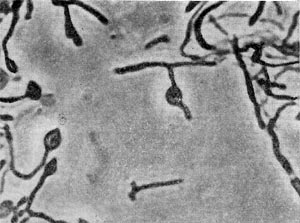 Рис. 92. Внутригифное (интеркалярное) образование спор у культуры из рода Intrasporangium.
Рис. 92. Внутригифное (интеркалярное) образование спор у культуры из рода Intrasporangium.В отличие от других форм у представителей рода микроспорангиум (Microsporangium) споры формируются в спорангиях на особых ветках — спорофорах, которые расположены пучками, прикрепленными к основанию спорангия (подобно кисточке). У организмов рода интраспорангиум (Intrasporangium) споры формируются также в спорангиях. В отличие от других организмов, образование спорангиев происходит интерка-лярно (внутригифно). В разных участках нитей мицелия образуется вздутие округлой или лимоновидной формы (от 5 до 20 мкм в диаметре). Спорангии заполнены кокковидными спорами (рис. 92).
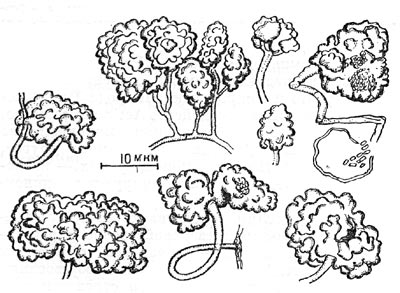 Рис. 93. Разнообразные формы спорангиев у Аmоrphosporangium.
Рис. 93. Разнообразные формы спорангиев у Аmоrphosporangium.У представителей рода элитроспорангиум (Elytrosporangium) споры формируются внутри бобовидных спорангиев в виде цепочек, которые образуются последовательно одна за другой. У организмов рода аморфоспорангиум (Аmоrphosporangium) спорангии, в которых находятся споры, имеют разнообразную неправильную форму (рис.. 93). Все вышеописанные организмы относятся к первому порядку лучистых грибков — Actinomycetales.
Семейства актинопланы (ACTINOPLANACEAE), дерматофилы (DERMATOPHILACEAE) и планоспоровые(PLANOSPORACEAE)
Эти семейства относятся ко второму порядку — Actinoplanales и объединяют организмы, которые в процессе развития образуют особые органы плодоношения и подвижные споры.
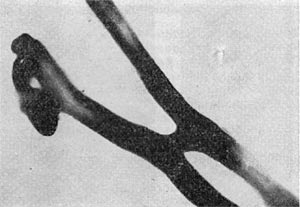 Рис. 94. Анастомоз у актиномицетов. Увел. X 20 000.
Рис. 94. Анастомоз у актиномицетов. Увел. X 20 000.Подвижными могут быть также фрагменты нитей вегетативного мицелия. Споры формируются в плодовых телах — спорангиях. Фрагменты образуются путем дробления нитей мицелия без формирования плодовых тел. Споры и клетки фрагментов снабжены жгутиками, число которых у разных представителей варьирует.
Семейство актиноплан состоит из 5 родов. Организмы, входящие в это семейство, имеют хорошо развитый субстратный и воздушный мицелий, не отличающийся от мицелия актиномицетов, но образующий подвижные споры, которые формируются в спорангиях. Спорангии имеют оболочку, форма их может быть различной: грушевидной у представителей рода ампуллариелла (Аmрullаriеllа),бочковидной у организмов рода пилимелиа (Pilimelia). У организмов рода китазатоа (Kitasatoa) споры формируются путем отчленения споро-носца; образуются короткие цепочки, которые покрыты уплотненной слизистой капсулой, похожей на спорангии. Настоящие спорангии не выявлены.
На таблице 39 показано общее строение представителей рода актинопланес (Actinoplanes) и споры со жгутиками, подвижная клетка организма из рода дерматофилюс (Dermato-philus), фрагмент мицелия со жгутиками представителей рода проактинопланес (Proactino-planes). Представители семейства дерматофилы (Dermatophilaceae) в процессе развития не образуют спорангиев. Культуры имеют хорошо развитый мицелий, который расчленяется на палочки и кокки. Клетки снабжены жгутиками (род проактинопланес — Proactinoplanes). У представителей рода дерматофилюс (Dermatophilus) нити мицелия в отдельных частях подвергаются дроблению в разных направлениях, образуются веретеновидные раздутые участки мицелия. Формирующиеся в результате дробления нитей клетки снабжены жгутиками.
Организмы, объединяемые в семейство пла-носпоровых (Planosporaceae), имеют споры на .коротких ножках мицелия. Споры палочковидные, со жгутиками, формируются открыто, окружены слизистой капсулой, одиночные, парные или сгруппированы в короткие цепочки. В это семейство входит 4 рода: планомоноспора (Planomonospora), планобиспора (Planobispora), спорихтиа (Sporichthya) и дактилоспорангиум (Dactylosporangium), отличающиеся между собой количеством образующихся на гифах спор.
Для актиномицетов описано соединение нитей мицелия при помощи так называемых анастомозов. Ветка одной нити своим дистальным концом прикасается к оболочке другой нити, оболочки их растворяются, образуется канал, соединяющий две нити (рис. 94). Этот процесс — соединение гиф — можно рассматривать как автогамию — слияние ядерных элементов и цитоплазмы (примитивная форма полового процесса). У некоторых организмов можно наблюдать при прорастании спор образование проростков — коротких трубочек, которые соединяются с трубочками другой споры. На месте их соединения образуется новый росток.
Были описаны процессы рекомбинации у актиномицетов, при которых клетки двух разных культур с определенными признаками соприкасаются оболочками. В результате из клетки в клетку передаются определенные генетические признаки. Выросшие из таких смешанных культур колонии нового организма обладают свойствами двух находившихся в контакте исходных культур.
Культуральные свойства лучистых грибков
Представители разных групп лучистых грибков обычно хорошо растут на синтетических питательных средах, как на плотных агаризо-ванных, так и на жидких. Развитие микроорганизмов зависит от состава и реакции питательной среды, температурного и воздушного режимов, света, количества и качества посевного материала и других факторов. Из культу-ральных показателей для разделения актиномицетов на группы наиболее значима окраска культур — пигментация. По этому признаку лучистые грибки делятся на две группы -бесцветные и пигментированные. Первые при росте на питательных средах не образуют никаких красящих веществ. Воздушный мицелий таких актиномицетов может быть белым, светло-серым, кремовым, нижняя сторона колонии бесцветная. Актиномицеты второй группы образуют красящие вещества — пигменты. Колонии их при росте на питательных средах приобретают различную окраску: синюю, фиолетовую, красную, розовую, желтую, оранжевую, зеленую, черную, коричневую. Часто колонии окрашены в смешанные тона (табл. 40).
Пигменты образуются при свободном доступе кислорода. В анаэробных условиях многие культуры становятся бесцветными, пигмент исчезает. Пигменты актиномицетов обладают разнообразными химическими и физическими свойствами. Одни из них хорошо растворяются в воде и этиловом спирте; другие не растворяются в воде, но растворяются в спирте, эфире и других органических растворителях; третьи не растворяются ни в воде, ни в органических растворителях.
Нерастворимые пигменты тесно связаны с плазмой, не выделяются из клетки и, следовательно, не проникают в питательную среду. Пигменты, растворимые в воде, легко выделяются наружу и проникают в среду, окрашивая ее в соответствующий цвет.
Многие актиномицеты имеют внешне одинаковую синюю окраску, но оказалось, что красящие вещества их неоднородны как по химическому составу, так и по биологическим свойствам. Установлено, что в основном красящие вещества синих актиномицетов относятся к хинонам. Синие пигменты чувствительны к реакции среды и могут менять свою окраску под действием кислот и щелочей, приобретая соответственно красный или синий цвет. При помощи препаративной хроматографии на бумаге ученым удалось установить, что синие пигменты состоят из 3 или 5 компонентов. Среди лучистых грибков есть культуры синего цвета, но их пигменты иной природы. Такие пигменты в кислых растворах приобретают желто-красную окраску, а в щелочных — зелено-синюю.
Красящие вещества, образуемые фиолетовыми актиномицетами, очень сложны и состоят из большого числа компонентов (до 15). Первый антибиотик мицетин был получен из культуры актиномицетов фиолетовой окраски.
При изучении красно-оранжевых актиномицетов установлено, что пигменты их близки к липоактинохромам грибов. Такие пигменты не растворяются в воде. Оранжевые проактиномицеты способны образовывать каротиноидные пигменты, подобные пигментам моркови.
Среди лучистых грибков, образующих желтые пигменты, найдены такие, которые продуцируют значительное количество рибофлавина — витамина, содержащегося в молоке. У культур, окрашенных в зеленый цвет, зеленые пигменты отличаются физико-химическими свойствами. В основном это железосодержащие соединения. У одного из этих пигментов установлен элементарный состав. Интересно, что в нем содержится до 9% железа. Пигмент назван ферровердином.
Около 50% культур актиномицетов способны образовывать бурое вещество. Побурение культур наблюдается и среди актиномицетов, пигментированных в иные цвета. Установлено, что бурый цвет обусловлен наличием пигмента меланоидного типа, а также способностью актиномицетов продуцировать ферменты тирозиназу и лакказу. По данным некоторых ученых, ферментные системы типа лакказы участвуют в образовании гумуса и гумусоподобных веществ. Бурые соединения различных актиномицетов отличаются физико-химическими и биологическими свойствами. Используя данные о характере и условиях образования бурого вещества, исследователи разделили актиномицеты на группы, каждая из которых характеризуется своими, отличными от других групп организмов свойствами.
Физиологические и биохимические свойства лучистых грибков
Лучистые грибки очень неразборчивы в выборе пищи. Они могут развиваться на скалах, где имеются только ничтожные количества питательных веществ, в грунтах, содержащих углеводороды, и в почвах, разлагая при этом гумусовые вещества, труднодоступные для других микроорганизмов. Актиномицеты успешно конкурируют с другими микроорганизмами почвы, способны легко изменяться под влиянием окружающих условий и приспособляться к среде. Благодаря таким свойствам они широко распространены в природе, могут легко выращиваться в лабораторных условиях. Лучистые грибки культивируют на жидких и твердых питательных средах растительного и животного происхождения. Наиболее распространенными питательными средами для выращивания актиномицетов являются мясо-пептонный агар (МПА), картофельный агар (КА) и синтетический агар (СА), состоящий из набора солей (NaCl, KN03, K2HP04, MgSO4. Всеядность актиномицетов указывает на наличие у этих организмов систем, обеспечивающих возможность существования в различных субстратах.
Представители лучистых грибков используют в качестве источников азотного питания различные соединения минерального азота в виде нитратов, аммонийных солей. Способность усваивать тот или иной источник минерального азота у разных представителей лучистых грибков различна. Одна группа культур предпочитает усваивать нитраты; другая — аммонийные соли (NH4N03, NH4C1). Лучистые грибки используют азот и из органических соединений (мочевина, пептон, различные аминокислоты). Степень .усваивания аминокислот у разных культур различна. Так, аспарагиновая и глутаминовая кислоты и пролин ассимилируются почти всеми организмами, хуже усваиваются гистидин, лейцин, серии. Некоторые аминокислоты (аргинин, тирозин, аланин) стимулируют у пигментированных культур способность окрашиваться более интенсивно. Почти все представители лучистых грибков могут расщеплять различные белки (казеин, желатин, кератин).
Описаны, кроме того, автотрофные актиномицеты, которые хорошо развиваются на минеральных средах в присутствии углекислого газа как единственного источника углеродного питания. Большинство лучистых грибков гете-ротрофы. Они усваивают углерод из клетчатки, органических кислот, полисахаридов, спиртов, крахмала, глицерина и др. У лучистых грибков отмечается большое разнообразие в усвоении различных источников углеродного питания. Сахароза, глюкоза, манноза, левулеза усваиваются почти всеми актиномицетами.
Свойство организмов по-разному относиться к источникам углеродного питания используется в диагностических целях для разделения изучаемых организмов на соответствующие группы. Многие представители лучистых грибков хорошо усваивают углеводороды (керосин, парафин, бензин). В литературе описаны культуры актиноми-цетов и проактиномицетов, которые способны потреблять углерод из других органических соединений, трудно поддающихся разложению (каучук, поливиниловые пленки, битумы, асфальты).
В развитии лучистых грибков большую роль играют микроэлементы. Так, недостаток марганца вызывает у проактиномицетов формирование раздутых нитей. Для активного развития проактиномицетов, кроме марганца, необходим цинк. Присутствие в среде марганца стимулирует продуцирование определенными культурами актиномицетов антибиотика стрептомицина. Необходимыми элементами для роста и развития отдельных актиномицетов являются калий, магний, цинк, железо. Для продуцирования культурами витамина В12 необходим кобальт.
Присутствие больших доз микроэлементов может оказывать угнетающее действие на рост и развитие культур.
Естественные радиоактивные вещества стимулируют быстрый рост и развитие микробов. У пигментных культур актиномицетов под их действием ускоряются образование пигмента, процесс образования аминокислот, накапливается большое количество биомассы.
Способность лучистых грибков поселяться, расти, размножаться на многих субстратах, использовать для своего развития самые различные источники питания объясняется тем, что в клетках этих организмов есть набор разнообразных ферментов, благодаря которым культуры могут разрушать и образовывать сложные органические вещества. Набор ферментов в клетке обеспечивает также все необходимые жизненные процессы, происходящие в ней, включая и ее воспроизведение. Представители лучистых грибков образуют протеолитические ферменты — протеазы, с помощью которых культуры разлагают белки животного и растительного происхождения.
Белки разлагаются актиномицетами или до конечных продуктов (сероводорода, аммиака и воды), или до образования промежуточных веществ (пептонов, аминокислот). Интенсивность разложения белков зависит от условий аэрации, состава питательной среды, температуры и других факторов.
Среди лучистых грибков есть организмы (особенно среди рода Actinomyces), способные разрушать кератин (основной компонент роговых частиц, волос) при помощи фермента кератиназы.
Имеются культуры, у которых обнаружен фермент хитиназа, разлагающий хитин (ороговевшие части насекомых, животных). У многих представителей лучистых грибков выявлен фермент амилаза, при помощи которого организмы расщепляют крахмал с различной интенсивностью, в зависимости от вида культуры. Одни культуры разлагают крахмал до декстринов, другие — до Сахаров. У некоторых актиномицетов обнаружен фермент инвертаза, который расщепляет сахарозу на легкоусвояемые сахара — глюкозу и фруктозу. Отмечено, что проактиномицеты могут усваивать сахарозу без ее разложения.
Актиномицеты способны расщеплять при помощи фермента липазы жиры и жироподобные вещества.
Многие актиномицеты могут активно преобразовывать (трансформировать) некоторые соединения в биологически активные вещества - гормоны (кортизон, преднизон, преднизолон и др.). Найдены актиномицеты, которые способны трансформировать особые, полициклические соединения — стероиды — с образованием стероидных гормонов, являющихся регуляторами ферментативных процессов в организмах. Лучистые грибки содержат и окислительно-восстановительные ферменты. Один из таких ферментов — лакказа, при помощи которого разлагаются фенольные соединения гидрохинон, катехол и др.
Большинство лучистых грибков развивается при свободном притоке кислорода. Однако отдельные культуры могут расти и при некотором ограничении доступа кислорода. Строгие анаэробы среди лучистых грибков встречаются редко.
Среди проактиномицетов анаэробы встречаются чаще, чем среди актиномицетов, они обнаруживаются в организме животных и человека. Большинство лучистых грибков растет и развивается при температуре в пределах 25—30 °С (мезофилы). Термофильные организмы с температурным оптимумом роста 45—60 °С встречаются редко и чаще всего обнаруживаются среди микромоноспор.
Термотолерантные, т. е. устойчивые к высоким температурам, актиномицеты выдерживают нагревание до 60—70°С в течение часа. Наблюдается повышенная устойчивость к нагреванию и у спор мезофильных актиномицетов. Для нормального роста лучистых грибков лучшей питательной средой является среда с нейтральной или слабо щелочной реакцией (рН 7—7,2).
Лучистые грибки хорошо переносят высушивание. Так, некоторые культуры актиномицетов после девятилетнего пребывания в сухом виде в лабораторных условиях не потеряли своей жизнеспособности.
Лучистые грибки могут развиваться и при низкой влажности субстрата. Показано, что оптимальной влажностью для актиномицетов является 60% (от полной влагоемкости). При 23—30-процентной влажности почвы актиномицеты преобладают над прочими микроорганизмами, а при 8 — 10-процентной остаются единственными растущими представителями почвенной микрофлоры.
Одна из характерных особенностей лучистых грибков — большая изменчивость. При наблюдении в микроскопе культур актиномицетов можно легко обнаружить разнообразие морфологии клеток. Одни клетки имеют однородную плазму, другие — зернистую, вакуолистую. Величина отдельных клеток может также сильно колебаться. Гифы мицелия в отдельных участках выглядят раздутыми и не окрашиваются основными красками. В других участках гифы могут покрываться почкообразными выростами. Можно сказать, что в культурах нет совершенно одинаковых двух-трех клеток. Такое явление называется полиморфизмом, или возрастной изменчивостью организма. И эта изменчивость не случайна, а биологически закономерна. Причем популяция клеток разнокачест-венна не только морфологически, но и биохимически. В одних клетках биохимические превращения протекают интенсивно, в других — медленно. Изменения в организме могут быть длительными и кратковременными.
Благодаря разнообразию своих клеток лучистые грибки имеют большую возможность приспособиться к различным условиям среды. Не будь этой разнокачественности клеток, вся культура погибла бы при первом же неблагоприятном воздействии на нее. Малейшие отклонения в составе питательной среды или условий культивирования вызывают изменения организма.
Культуральный полиморфизм у представителей лучистых грибков проявляется разнообразно. У одной и той же культуры может меняться внешний вид колонии, они могут быть гладкими, бугристыми, морщинистыми. В одних случаях колонии обильно покрыты воздушным мицелием, в других — он слабо развит или совсем отсутствует. Пигментированные культуры могут обесцвечиваться.
Отмечаются отклонения и в образовании спороносцев. Одна и та же культура может образовывать то спиральные, то неспиральные спороносцы, то длинные, то короткие нити. Клетки могут различаться между собой быстротой роста, размножения, формирования спор. Рост и развитие организма протекает в определенных пределах, свойственных каждому организму и обусловленных его наследственными признаками. Когда же изменяется среда, переставая быть привычной для организма, организм либо гибнет, либо приспосабливается к новым условиям, меняя свои свойства. Получается новый вариант организма.
Ученые наблюдали образование таких вариантов под влиянием изменившейся среды или под воздействием внешних факторов: лучистой энергии, рентгеновских и ультрафиолетовых лучей, химических агентов и др. В результате таких воздействий получаются наследственно закрепленные варианты.
Изменения затрагивают как внешние морфологические и культуральные признаки, так и биохимические.
В процессе длительного выращивания лучистых грибков на той или иной питательной среде микроорганизмы постепенно начинают потреблять соединения, которых они до этого не усваивали. Адаптация к питательному субстрату особенно ярко выражена у актиномицетов.
Такую физиологическую перестройку можно вызвать у организмов в отношении многих источников углеродного, азотного питания, а также дополнительных веществ — витаминов, аминокислот и др. Последовательно приучая микроорганизмы к тому или иному субстрату или индивидуальному веществу, можно получить так называемые зависимые мутанты. Эти мутанты уже не растут без веществ, к которым приспособились. Мутационные изменения могут быть морфологического, физиологического и биохимического характера.
Морфологические изменения у актиномицетов хорошо проявляются при образовании мутантов, которые потеряли способность формировать воздушный мицелий. Колонии таких культур голые, на поверхности спороносцы и споры не образуются. Весьма показательны мутации организмов с потерей физиологического признака — способности окрашиваться. Такие мутанты резко отличаются от исходной культуры по цвету. Часто можно встретить культуры, которые утратили способность образовывать такие вещества, как антибиотики, аминокислоты, витамины и др.
Биологически активные вещества, продуцируемые актиномицетами
Лучистые грибки обладают очень ценным свойством — способностью образовывать весьма разнообразные вещества, многие из которых имеют большое практическое значение. В естественных местах обитания между микроорганизмами складываются различные взаимоотношения.
В природе широко распространено явление симбиоза и антибиоза.
Подавление жизнедеятельности одних микроорганизмов другими связано с выделением различных продуктов жизнедеятельности, в том числе специфических химических веществ — антибиотиков, обладающих способностью убивать окружающих микробов или препятствовать их росту.
Подробнее об антибиотиках, в том числе и о продуцируемых актиномицетами, будет рассказано в других главах книги. Актиномицеты могут продуцировать также вещества, угнетающие рост и развитие растений и полезной микрофлоры. К этим веществам относятся фитотоксины. Некоторые из них резко подавляют рост растений (смоченные ими семена не прорастают). Другие токсины действуют слабее, они только задерживают прорастание семян и рост проростков.
Некоторые токсины вызывают внешне слабо выраженное угнетение роста растений, которое, однако, отражается на биохимических процессах, протекающих в тканях. В таких растениях нарушается химический состав. Актиномицеты-ингибиторы живут в различных почвах, особенно часто их обнаруживают в подзолистых и красноземах. При большом скоплении токсинов происходит отравление почвы (утомление). На таких почвах развитие растений угнетается, урожай снижается.
Но если в такую почву внести препараты, содержащие актиномицеты-антагонисты, специально подобранные к микробам, которые образуют токсические вещества, то под действием таких актиномицетов происходит устранение микробов-токсинообразователей и почва становится менее токсичной для растений. Оздоровляющее действие они оказывают также на организм человека и животных при инфекционных заболеваниях. Между микробами положительного и отрицательного действия возникают сложные взаимоотношения, в результате которых создаются определенные микробные ценозы — сообщества.
Живое население почвы следует рассматривать как важный фактор плодородия почвы, от которого зависит урожайность растений. Представители лучистых грибков играют в этом процессе одну из ведущих ролей.
Лучистые грибки обладают способностью образовывать биологически активные вещества, которые стимулируют рост и развитие высших и низших организмов. Из культур актиномицетов были выделены такие вещества, как биотин, тиамин, рибофлавин, пантотеновая и никотиновая кислоты, каротиноидные пигменты, аминокислоты, ауксины и другие ростовые вещества. Часть образованных актиномицетами веществ утилизируется самими продуцентами, а избыток выделяется в среду обитания. Обогащение субстрата биологически активными веществами происходит и за счет распадающихся микробных клеток. Продуцирование лучистыми грибками тех или иных веществ зависит от возраста культуры, вида микроорганизмов и условий культивирования. В почве происходят непрерывные процессы синтеза и разрушения биологически активных веществ. Их количество в почве определяется интенсивностью деятельности микробов и скоростью разрушения или длительностью сохранения.
Биовещества микробного происхождения положительно влияют на растения, усиливая в них биологические процессы, увеличивая содержание белков, аминокислот, витаминов и ряда других соединений, повышающих качество урожая.
Активные вещества актиномицетного происхождения применяются в животноводстве, а также для защиты растений от вредоносных насекомых.
Для борьбы с непарным шелкопрядом очень эффективным оказался виоларин, выделенный из культур фиолетовых актиномицетов (Act. violaceus). На таблице 41 показано действие антибиотика на гусениц непарного шелкопряда.
Почти все культуры актиномицетов способны продуцировать витамины группы В. Так, Act. olivaceus образует антианемический витамин В19. Витамин В12 практически не встречается в растениях. Его получают из печени крупного рогатого скота и из микробов — пропионовокислых бактерий и актиномицетов. Актиномицеты хорошо растут, развиваются и образуют витамин В12 на питательной среде, в состав которой входит молочная сыворотка, янтарнокислый аммоний и мочевина.
Бродильной, текстильной, кожевенной и другим отраслям промышленности требуются химически чистые препараты ферментов. Для удовлетворения потребности народного хозяйства в ферментах весьма перспективно использование актиномицетов. Так, кератиназу, применяемую в кожевенной промышленности для удаления шерсти со шкур, получают из культур Act. fradiae. На рисунке 95 показано действие кератиназы на коровий волос.
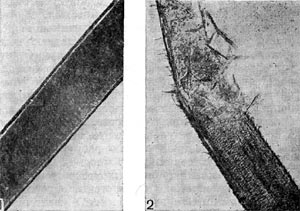 Рис. 95. Действие фермента кератиназы, полученной из актнномицета, на волос: I — волос, не обработанный ферментом; 2 — волос, обработанный ферментом кератиназой.
Рис. 95. Действие фермента кератиназы, полученной из актнномицета, на волос: I — волос, не обработанный ферментом; 2 — волос, обработанный ферментом кератиназой.При помощи некоторых культур актиномицетов были получены стероидные гормоны. В медицине гормоны широко применяются для лечения различных заболеваний. Стероидные гормоны до недавнего времени получали из желез внутренней секреции животных. Но для выработки, например, 1 кг кортизона нужно забить несколько тысяч голов крупного рогатого скота.
Некоторые растения, например паслен птичий, содержат химические вещества, из которых можно получить кортизон. Но выделить эти вещества из растений очень трудно, выход гормона низок.
Порядок микобактерии (MYCOBACTERIALES)
В этот порядок входят организмы с палочковидными грамположительными клетками. Для типичных форм свойственно хорошо выраженное ветвление. Ветвящиеся клетки на поздних стадиях развития культур превращаются в кокко-видные формы. В семейство Mycobacteriaceae входят следующие роды: микококки (Mycococcus), пропионово-кислые бактерии (Propionibacterium), микобактерии (Mycobacterium), лактобак-терии (Lactobacterium), псевдобактерии (Pseudobacterium) и близкие к ним артробактерии (Arthrobacter), целлюломонас (Cellulomonas), коринебактерии (Corynebacterium), бревибактерии (Brevibacterium) и другие микоформы.
Свойства микобактерии далее будут подробно рассмотрены на примере двух родов: Mycobacterium и Mycococcus.
Род микобактерии (MICOBACTERIUM)
Микобактерии давно служат объектом разносторонних исследований. После того как Р. Кох в 1882 г. открыл возбудителя туберкулезного заболевания, начались многочисленные поиски этих организмов в природе.
В связи с этим большое значение имеет получение стероидных гормонов путем трансформации стероидов с помощью микроорганизмов. Например, микробиологический метод получения кортизона состоит в том, что к углероду, находящемуся в 12-м положении, присоединяется атом кислорода. Ученые показали, что эту реакцию могут легко и быстро осуществлять актиномицеты.
Впервые превращение стероидов микроорганизмами наблюдал Т. А. Таусонв 1932 г. При помощи микроорганизмов были получены кор-тикостероиды: кортизон и гидрокортизон, а из них — преднизон и преднизолон.
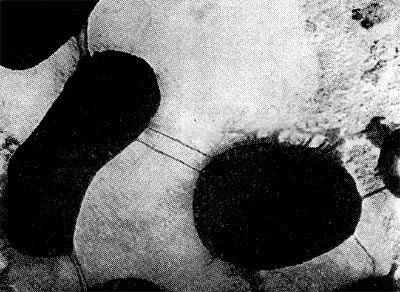
Рис. 96. Клетки Mycobacterium lacticolum. var. aliphaticum. Увел. Х 40 000.
Приведенным перечнем веществ, продуцируемых лучистыми грибками, не исчерпываются их возможности как продуцентов биологически активных веществ. Так, актиномицеты способны образовывать из простых углеводородов сложные органические вещества: белки, жиры, углеводы и другие соединения.
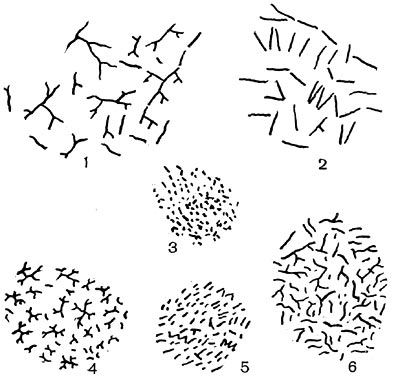
Рис. 97. Общая картина микроскопических препаратов микобактерий. Односуточные культуры на синтетической агаризованной среде. Увел. X 600. (По Н. А. Красильникову.) 1 — Mycobact. hyalinum; 2 — Mycobact. rubrum; 3 — Mycobact. cyaneum; 4 — Mycobact. bifidum; 5 — Mycobact. citreum; 6 — Mycobact. filiforme.
Нет сомнений, что среди лучистых грибков есть и такие, которые могут продуцировать и более важные вещества, чем упомянутые выше. Выявить такие микроорганизмы и заставить их работать на пользу человека — задача микробиологов.
Кох предполагал, что, кроме туберкулезной палочки, в природе существуют другие близкие к ней бактерии. Это предположение вскоре подтвердили многочисленные авторы, которые находили организмы, внешне похожие на туберкулезные, на разных субстратах: сливочном масле, молоке, траве, в почве, воде и т. д.
Морфология и физиологические свойства
Если нитчатое строение и ветвление клеток актиномицетов имеет у проактиномицетов нестойкий и непостоянный характер, то у микобактерии мы находим только некоторые элементы такого строения. У микобактерии мицелий вообще не образуется. На ранней стадии развития (в первые сутки) микобактерии имеют палочковидное строение клеток, и в этот момент они морфологически похожи на проактиномицетов, находящихся во второй стадии развития. Палочковидные клетки микобактерии, в отличие от бактериальных, имеют неправильные очертания: контуры их искривлены, в разных местах они неодинаковой толщины, часто кол-бовидно раздутые, клетки более или менее изогнуты, одиночные или соединены в пары или короткие цепочки (рис. 96). Цепочки никогда не бывают правильно очерченными и прямыми,. строго расположенными в одну линию, как это наблюдается в культурах бактерий; обычно они угловато искривленные. На рисунке 97 показан общий вид односуточных культур разных видов микобактерий, наиболее типичных по своему строению и расположению клеток.
Величина клеток микобактерий меняется в зависимости от вида культуры и состава среды. В молодом возрасте чаще всего клетки имеют длину 2,5— 7,0 мкм. Нередко встречаются организмы, величина которых не превышает 2—3 и даже 1—2 мкм, немало форм и с более длинными клетками, 10—15 мкм. Поперечник клеток у разных видов микобактерий также различен; чаще всего он равен 0,6—0,7 мкм. Однако нередко встречаются культуры с толщиной клеток 0,2—0,3 и 0,8—1,0 мкм. Толщина клеток микобактерий — величина более постоянная, чем длина.
В культурах микобактерий более старого возраста (2—3-суточных) клетки укорачиваются (рис. 98) и принимают кокковидную форму. Кокковидные клетки имеют такой же диаметр, как и палочки, или несколько больший; одиночные, или соединены в пары, или короткие кривые цепочки, или механически сцеплены в кучи. На этой стадии развития микобактерий легко можно принять за микрококки. Кокковидные клетки некоторое время продолжают размножаться, а затем переходят в состояние покоя. Таким образом, микобактерий в своем развитии проходят цикл превращений из палочковидных форм в кокковидные. Поэтому, чтобы с достоверностью установить принадлежность организма к микобактериям, надо вести последовательное наблюдение за его развитием.
Рис. 98. Последовательное развитие клеток Mycobact. hyalinum на сусло-агаре. Увел. X 600. (По Н. А. Красильникову.) 1 — 1-суточная культура; 2 — 2-суточкая культура; 3 — 3-суточная культура; 4 — 10-суточная культура.
Другим характерным морфологическим признаком микобактерий является ветвление. Ветки образуются на боковой поверхности палочковидных клеток так же, как у проактиномицетов и актиномицетов. Степень ветвления у разных микобактерий неодинакова: у одних клетки при благоприятных условиях образуют многочисленные ветки, по 2—5 на каждой клетке, у других обычно по 1—2 ветки (рис. 97). У многих видов ветвящиеся клетки встречаются вообще редко, а на некоторых средах вообще не обнаруживаются. Наконец, имеется много культур, у которых ветвление обнаруживается только при особых условиях культивирования. Например, у синих (Мусоbacterium cyaneum) и черных (Mycobact. nigrum) микобактерий ветвления на обычных средах (МПА, сусло-агар) не наблюдается, клетки имеют бактериальное строение; при посеве их на ломтики картофеля или в жидкие среды обнаруживается большое количество типичных ветвящихся клеток. Следовательно, ветвление у микобактерий зависит в значительной степени от питательной среды.
В тех случаях, когда культура вызывает сомнение в принадлежности к микобактериям, приходится проверять ее на различных средах, чтобы обнаружить ветвление. Ветвление у микобактерий, как правило, наблюдается только в ранней стадии развития, в период наиболее бурного роста и размножения клеток. В старых культурах ветвящиеся формы не встречаются.
Все микобактерии неподвижны, окрашиваются по Граму положительно, кислотоупорны. При развитии в жидких средах эти микроорганизмы вызывают равномерное помутнение сред. Колонии микобактерии всегда тестообразной консистенции; поверхность их гладкая, реже бугристая или складчатая; у некоторых видов микобактерии колонии слизистые, растекаются по поверхности агара. Культуры микобактерии пигментированы — синие, красные, оранжевые, желтые, зеленые, черные; встречаются и бесцветные.
Развиваются микобактерии на различных субстратах. Они хорошо усваивают белки, углеводы, жиры, воск, парафин. Ферментативная деятельность у разных видов различна: как правило, красные микобактерии обладают слабой ферментативной активностью, лимонно-желтые или белые образуют очень активные ферменты. Среди микобактерии есть формы, хорошо развивающиеся на безазотистой среде, способные усваивать азот атмосферы.
Микобактерии не обладают антагонистическими свойствами и не образуют антибиотиков.
РазмножениеМикобактерии размножаются делением, перешнуровыванием и почкованием. Наиболее часто встречается деление (рис. 99). В клетках, достигших определенной величины, образуются поперечные перегородки, и клетки распадаются пополам, разламываясь как бы от сильного толчка. Перелом клеток происходит настолько быстро, что уловить этот момент бывает очень трудно, наблюдая за делением клеток в микроскоп. После перелома дочерние клетки располагаются под углом друг к другу или параллельно (рис. 99,7).
При размножении клетки перешнуровыванием (рис. 99,2) сначала появляется едва заметная перетяжка, которая постепенно углубляется, становится все более заметной, и клетка перетягивается пополам. Иногда'клетка перешнуровывается одновременно в нескольких местах.
Почкование у микобактерии встречается довольно часто. Почки образуются чаще на конце клетки или на боковой поверхности (рис. 99,5). Сначала появляется маленький бугорок, который увеличивается, округляется, затем отваливается или, оставаясь соединенным с материнской клеткой, развивается дальше. Почки, часто вытягиваясь в длину, превращаются в палочковидные ветки. Трудно в таких случаях установить, что считать почкой, а что -веткой, так как и почкование, и ветвление представляют, в сущности, один и тот же процесс. Различие заключается лишь в том, что при настоящем ветвлении ветки не отделяются и не могут существовать самостоятельно. Почкование у микобактерии чаще наблюдается при росте на сусло-агаре и ломтиках картофеля.
Рис. 99. Размножение микобактерпй. (По Н. А. Красильникову.) Увел. X 3000. 1 — деление клеток; 2 — перешнуровывание клеток; 3 — почкование.
Микобактерии могут образовывать споры. При этом плазма внутри клетки распадается на отдельные участки — фрагменты, которые слегка сжимаются и уплотняются (рис. 100). Эти фрагменты представляют собой самостоятельные зародышевые тельца — споры. На образование спор затрачивается все содержимое клеток. По мере формирования спор оболочка клетки постепенно ослизняется, становится менее заметной, наконец, исчезает, и споры освобождаются. По способу образования и биологическому значению споры микобактерий резко отличаются от эндогенных спор бактерий. Эндогенные споры хорошо переносят неблагоприятные условия, способствуя сохранению вида. Как правило, в клетке формируется одна спора, редко две, причем по внешним признакам такие клетки резко отличаются от вегетативных. В клетке микобактерий всегда образуется несколько спор, которые неустойчивы к внешним воздействиям; по внешним признакам они мало отличаются от вегетативных форм; спорообразование является одним из способов размножения.
Рис. 100. Спорообразование у Mycobact. hyalinum. (По Н. А. Красилышкову.) Увел. X 3000: 1 — концентрация плазмы на отдельные участки-фрагменты; г, s — уплотнение фрагментов и превращение их в споры; 4 — растворение оболочки клеток; 5 — зрелые споры.
Парафинокисляющие микобактерии
Одной из наиболее интересных особенностей микобактерий является их способность разлагать такие химически инертные соединения, как углеводороды, содержащиеся в нефти.
Предельные углеводороды вследствие строения молекул не вступают в реакции присоединения, а в реакции замещения вступают лишь при высоких температурах и давлении. Такие углеводороды и названы парафинами, что означает «обладающий малым сродством».
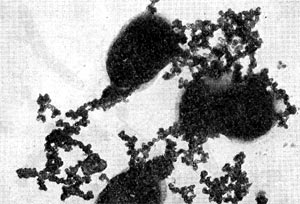
Рис. 101. Культура Mycobact. ceroformans на среде с гексадеканом. Увел. X 20 000.
В последнее время ученые многих стран мира занимаются изучением углеводородокисляющих микроорганизмов. Такой повышенный интерес к ним связан с тем, что с помощью подобных микроорганизмов открываются возможности получения технического белка и других ценных продуктов из непищевого сырья, а также борьбы с нефтяными загрязнениями биосферы.
Лучистые грибки составляют основную массу микроорганизмов, способных усваивать углеводороды. Впервые углеводородокисляющие лучистые грибки были описаны голландским микробиологом Зенгеном, который обнаружил их в садовой почве, воде каналов и навозе. Для выделения этих микроорганизмов в чистую культуру Зенген применил простой, но эффективный метод. Он приготовил в колбах раствор минеральных солей, необходимых для развития микробных клеток. К этому раствору Зенген добавил парафин. В колбы со средой ученый внес комочки почвы. Поскольку парафин являлся единственным органическим веществом в среде, то в колбах развивались только те микроорганизмы, которые могли его усваивать. Таким методом Зенген в 1913 г. выделил 6 видов микобактерий, которые хорошо развивались на нефти или ее очищенных фракциях — бензине, парафиновом масле, твердом парафине.
Исследования Зенгена помогли понять, каким образом из каналов и рек постепенно исчезает нефть, оставленная судами. Ее разлагают микроорганизмы. Позднее парафинокисляющие лучистые грибки были найдены и другими исследователями в различных почвах, воде и иле водохранилищ; при этом чаще всего встречались микобактерии. Особенно богаты парафин-окисляющими микобактериями почвы и пластовые воды нефтеносных районов, а также почвы на территории гаражей, нефтеперерабатывающих заводов, стоянок сельскохозяйственных машин и т. д.
Парафинокисляющие микобактерии характеризуются способностью легко разлагать углеводороды. Это свойство, как оказалось, присуще обширной группе микобактерий. Поэтому большая часть парафинокисляющих микобактерий была отнесена выделившими их исследователями к известным видам. Если суммировать эти данные, то мы увидим, что видовой состав парафинокисляющих микобактерий не слишком разнообразен и составляет примерно 20 видов. Наиболее часто встречаются Мусоbact. lacticolum, Mycobact. flavum, Mycobact. luteum, Mycobact. luteum, Mycobact. mucosum. Поскольку большая часть парафинокисля-ющих микобактерий принадлежит к известным видам, то строение их клеток типично для этих видов. Отличием является несколько меньший размер клеток культур, растущих на среде с парафином. Например, клетки Mycobact. lacticolum var. aliphaticum при росте на мясопептонном агаре имеют длину 3—4 мкм и толщину 0,8—1 мкм, на среде с парафином клетки этой 'же культуры мельче (длина 2—3 мкм и ширина 0,4—0,6 мкм).
Кроме известных видов, ученые обнаружили и такие культуры, которые по своим свойствам не совпадали ни с одним из описанных. Например, был выделен новый вид — Mycobact. viridae. Эти микроорганизмы отличались от остальных тем, что росли только на среде с парафином и не развивались на обычно употребляемых питательных средах; кроме того, они образовывали ярко-зеленый пигмент. Описано два новых вида парафинокисляющих микобактерий — Mycobact. ceroformans и Mycobact. раraffmicum. Исследование клеток этих организмов с помощью электронного микроскопа показало, что они обладают интересными морфологическими особенностями, не найденными до сих пор у микобактерий других видов. Оказалось, что клетки Mycobact. ceroformans окружены гроздевидными образованиями, которые прикреплены к оболочке клетки и состоят из отдельных округлых гранул (рис. 101). Сама оболочка имеет неровную, бугристую поверхность, усеянную тонкими нитями. Из крупных бугров на поверхности клетки, очевидно, и происходит выделение гранулярного вещества (рис. 102). Причем подобные гроздевидные структуры отсутствуют, если клетки Mycobact. ceroformans выращены на среде без углеводородов.
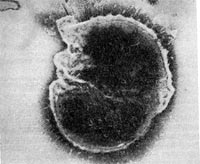
Рис. 102. Клетка Mycobact. ceroformans на среде с гексадеканом. Увел. X 30 000.
Клетки Mycobact. paraffinicum обладают длинными нитевидными выростами, при помощи которых они соединяются между собой и образуют гроздевидные или розетковидные скопления (рис. 103). Эти выросты отходят, как правило, от боковых сторон палочковидных клеток. В обычном микроскопе они видны уже в молодой (8-часовой) культуре, в суточной культуре выростов становится больше. При помощи этих выростов клетки соединяются друг с другом, образуя крупные скопления, состоящие из многих десятков, а иногда и сотен клеток (рис. 104). В электронном микроскопе видно, что выросты от разных клеток, встречаясь, спирально закручиваются один вокруг другого, образуя узловатые стволы — утолщения (рис. 105). К этим утолщениям присоединяются все новые выросты от других клеток. В конце концов, образуются очень крупные корневидные структуры, толщина которых может превышать диаметр вегетативных клеток (рис. 106). Подобные структуры клетки Mycobact. paraffinicum образуют не только на среде с парафином, но и на других средах. Однако меньше всего их наблюдается при выращивании культуры на самой богатой питательными веществами среде — мясопептонном агаре.
Рис. 103. Культура Mycobact. paraffinicum. Соединение клеток при помощи выростов. Увел. X 2400.
Роль этих структур в жизни клеток еще не выяснена. Возможно, при их помощи происходит обмен продуктами метаболизма отдельных клеток или осуществляется максимальный контакт с субстратом. Последнее обстоятельство для парафинокисляющей культуры чрезвычайно важно. Действительно, ведь углеводороды нерастворимы в воде. Несмотря на это, углево-дородокисляющие микобактерии прекрасно развиваются в водной среде с парафином. Как же осуществляется контакт между ними и субстратом? Оказалось, что клетки микобактерии прочно прикрепляются к каплям парафина, окружая их плотным слоем (рис. 107), и в этом процессе, по-видимому, определенную роль играют поверхностные клеточные структуры. Постепенно парафин из капли «выедается», а слой клеток нарастает.
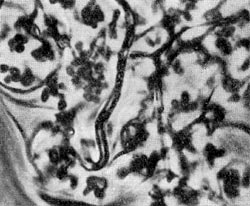
Рис. 104. Скопление клеток Mycobact. paraffinicum, соединенных выростами. Увел. X 2400.
Большинство парафинокисляющих микобактерии, кроме углеводородов, может использовать и другие субстраты — сахара, органические кислоты, высшие спирты, жиры и пр. Но среда с углеводородом является для микобактерии оптимальной. Очень немного таких культур, которые нормально растут и развиваются только на среде с углеводородом (или продуктами его окисления), а при переносе на среды с другими субстратами погибают. Такова, например, Mycobact. ceroformans. Химическое строение углеводородов очень разнообразно. Различают ациклические, алициклические и ароматические углеводороды. Ациклические углеводороды представляют собой соединения с открытой цепью углеродных атомов, не содержащие в молекулах колец, или циклов. Они могут быть предельными, или насыщенными (парафины), и непредельными (ненасыщенными), с двойными или тройными связями между атомами углерода. К алициклическим соединениям относят все вещества, содержащие кольца из углеродных атомов, кроме бензола и его производных. Наконец, к ароматическим углеводородам относятся вещества, имеющие в молекуле особую кольцевую группировку — бензольное ядро. И отношение углеводородокис-ляющих микобактерии к этим соединениям неодинаково.
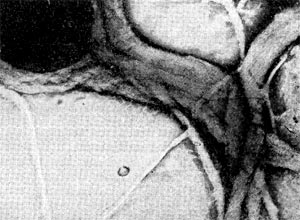
Рис. 105. Отростки от разных клеток Mycobact. paraffinicum при встрече закручиваются вокруг друг друга. Увел. X 42 000.
Ациклические углеводороды окисляются микобактериями гораздо легче ароматических. Однако разные группы ациклических углеводородов окисляются лучистыми грибками также с разной интенсивностью. Газообразные углеводороды — метан, этан, пропан и бутан — используются многими микобактериями, но с отчетливо выраженной приспособленностью микроорганизма к одному определенному соединению. Так, известно несколько видов мико-бактерий, окисляющих только метан. Очень немногие лучистые грибки могут усваивать жидкие летучие углеводороды (от пентана до октана). Углеводороды с числом углеродных атомов от 12 до 18 наиболее доступны. Однако и к ним разные штаммы относятся неодинаково. Например, Mycobact. paraffinicum предпочитает углеводороды с цепочкой из 16 —18 атомов углерода, a Mycobact. lacticolum var. aliphaticum — с цепочкой из 13—18 атомов. Все углеводороды с прямой цепью усваиваются микобактериями легче, чем с разветвленной; ненасыщенные легче насыщенных. Даже такие вещества, как асфальт, битумы, резина, каучук, разрушаются лучистыми грибками.
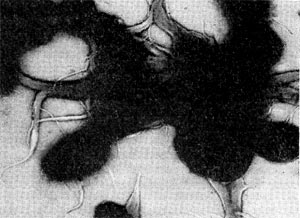
Рис. 106. Культура Mycobact. paraffinicum. Образование крупных корневидных структур. Увел. X 20 000.
Mycobact. citreochromogenum, найденная в образцах подземных вод нефтеносных районов, окисляет различные ароматические углеводороды, но особенно хорошо нафталин. Этот микроорганизм разлагает также и парафины.
Механизм разложения углеводородов. Окисление углеводородов микобактериями представляет собой ряд ферментативных реакций, следующих одна за другой, конечным продуктом которых является жирная кислота — наиболее окисленное соединение:
СН3-(СН2)п-СН2-СН3->- СН3—(СН2)„—СН2—СН2ОН ->СН3-(СН2)-СН2-СНО -> СН3—(СНа)—СН2-СООН. спирт углеводород альдегид кислота
Самым важным в этой цепи является первый этап — введение кислорода в молекулу углеводорода. Первичное окисление парафинов микобактериями может идти двумя путями:
1) в окисляемую молекулу вводятся два атома кислорода, образуется гидроперекись, которая затем превращается в спирт:
СН3-(СН2)n-СН3 -> СН3-(СН2)n - СН2-0-ОН H2-> СН3-(СН2)n - СН2ОН+Н20;
2) в окисляемую молекулу вводится один атом кислорода, спирт образуется сразу:
O2, H2 СН3-(СН2)П-СН3 - -> СН3-(СН2)n-СН2ОН+Н20.
Интенсивность окисления углеводорода зависит от того, насколько насыщена среда кислородом, т. е. от аэрации. Спирты и альдегиды являются промежуточными продуктами окисления углеводородов, в клетках они не накапливаются. Конечный продукт окисления — кислоты. С помощью метода газожидкостной хроматографии было выявлено, что при окислении высокомолекулярных парафинов в клетках мико-бактерий обычно накапливаются жирные кислоты с таким же числом углеродных атомов, какое имел исходный углеводород. В меньшем количестве присутствуют кислоты, углеродные цепи которых укорочены на два углеродных фрагмента. Так, в клетках Mycobact. paraffinicum, окисляющей углеводород гексадекан С16Н34, содержатся следующие жирные кислоты: пальмитиновая С16Н3202 (74%), маргариновая С14Н28О2 (18%), лауриновая С12Н2402 (6%) и каприновая С10Н2002 (2%).
Жирные кислоты в свободном состоянии содержатся в клетках в небольшом количестве. Часть их используется микобактериями на синтез клеточных жиров и жироподобных веществ — липидов. Другая часть жирных кислот расщепляется на низкомолекулярные вещества, использующиеся клеткой для построения белков, углеводов и других необходимых соединений.
Липиды парафинокисляющих микобактерий, как, впрочем, и других микроорганизмов, представляют собой производные жирных кислот — триглицериды, воск и ряд специфических соединений. Все это — вещества сложно-эфирной природы. Так, триглицериды, выделенные из клеток Mycobact. paraffinicum, окисляющей гексадекан, представляют собой эфиры глицерина и трех жирных кислот — пальмитиновой, маргариновой и лауриновой. Причем преобладает в этой смеси соединение, называемое трипальмитином.
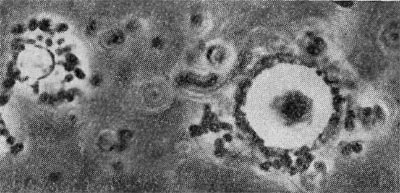
Рис. 107. Клетки Mycobact. ceroformans на каплях парафина. Увел. X 2300.
Трипальмитин входит в состав многих природных жиров, в частности сливочного масла.
Воска — это тоже сложные эфиры, образованные высшими жирными кислотами и высшими спиртами. Некоторые виды парафинокисляющих микобактерий накапливают в клетках большое количество воска. Например, в культуре Mycobact. ceroformans при выращивании на среде с гексадеканом накапливается в больших количествах воск цетилпальмитат, который образуется из цетилового спирта и пальмитиновой кислоты. Исследование липидов парафинокисляющих микобактерий помогает раскрыть механизм окисления углеводородов разными штаммами микобактерий.
Распространение в природе
Микобактерий широко распространены в природе. Среди них есть как патогенные виды, вызывающие тяжелые заболевания у человека и животных, так и безвредные организмы, часто встречающиеся в почве, воде, пищевых продуктах.
Толчком к изучению микобактерий послужила их патогенность. Первым был открыт возбудитель туберкулеза — Mycobact. tuberculosis, о котором упоминалось в начале главы. Попадая в организм животного или человека, туберкулезная микобактерия поселяется на ткани и начинает размножаться. Образуется небольшой бугорок сероватого цвета, в центре которого находится скопление клеток микобактерий. Постепенно отдельные бугорки сливаются, омертвевшая ткань превращается в крошковатую желтую массу, образуется так называемый творожистый некроз. В случае поражения легких эта творожистая масса выделяется при кашле, а на месте некроза остается большая полость (каверна).
С глубокой древности известна людям болезнь проказа. В 1874 г. норвежским врачом Гансеном был открыт возбудитель проказы — Mycobact. leprae. К микобактериям относится и возбудитель дифтерии — Mycobact. diphtheriae (синоним — Corynebacterium diphtheriae). Поселяясь на слизистой зева или носа, эти организмы начинают выделять токсическое вещество. Дифтерийный токсин — один из самых сильных биологических ядов. Проникая в кровь, он поражает сердце, почки, надпочечники и нервы; иногда возможен летальный исход. Токсин нейтрализуется антитоксином, который есть в организме больного (естественный иммунитет) либо вводится в виде сыворотки. Недавно установлено химическое строение дифтерийного токсина. Он представляет собой сложный эфир миколовой кислоты и дисахарида трегалозы. Помимо описанных возбудителей туберкулеза, проказы, дифтерии, есть и другие виды микобактерий, патогенные для человека и животных. Фитопатогенные формы встречаются редко.
Наряду с описанными существует очень много микобактерий совершенно безвредных. Это — сапрофитные формы. Большая часть их обитает в почве, где принимает активное участие в минерализации органических остатков. Они могут разлагать такие вещества, которые недоступны другим микроорганизмам или плохо усваиваются, например нефтяные остатки, воск, гуминовые соединения и др. Микобактерий прекрасно развиваются в почве с минимальной влажностью, при температуре, которая задерживает рост других организмов, а также в почвах с большим содержанием солей. Благодаря этим особенностям микобактерий играют особенно важную роль в превращении органических веществ в засушливых жарких районах, а также засоленных почвах.
Микобактерий принимают участие в процессах силосования, квашения, в приготовлении некоторых молочнокислых продуктов и сыров.
Применение
Микроорганизмы, «поедая» углеводороды, содержащиеся в нефти, накапливают значительное количество клеточной массы. Более половины этой массы составляет белок. Таким образом, выращивая парафинокисляющие микроорганизмы на нефтяных фракциях, можно получать белок из непищевого сырья. Для получения белка из углеводородов используют дрожжевые организмы, так как белок парафинокисляющих лучистых грибков, в частности микобактерий, менее ценный. Однако лучистые грибки, окисляющие углеводороды, способны синтезировать ряд ценных соединений. Это их свойство может быть использовано в народном хозяйстве. Например, как уже упоминалось, Mycobact. ceroformans превращает гексадекан в цетилпальмитат, кото-рый широко применяется в парфюмерной промышленности. Добывают это вещество из головного мозга кашалотов. Парафинокисляющие микобактерий синтезируют разнообразные витамины. Одни штаммы образуют витамины группы В, в частности рибофлавин. Другие накапливают каро-тиноиды — вещества, близкие к витамину А. Найдены и такие микобактерий, которые, окисляя углеводороды, выделяют в среду значительные количества аминокислот.
Известно несколько штаммов микобактерий, превращающих нафталин в салициловую кислоту, из которой приготовляют аспирин. В настоящее время при получении витаминов и аминокислот используется дорогое пищевое сырье, например сахара. Из приведенных примеров видно, что его можно заменить нефтяными углеводородами. Работа в этом направлении очень перспективна.
Есть еще одна область, в которой парафинокисляюгцие микобактерий могут сыграть существенную роль. За прошедшие 40 лет загрязнение нефтепродуктами рек, морей, океанов, почвы и атмосферы возросло во много раз. По данным американского журнала «National geografic magazin», каждый год выбрасывается в океаны от 3 до 10 млн. т нефти. Так, Тур Хейердал находил нефтяные шарики и пленку далеко в океане на протяжении всего плавания на «Ра-2».
К каким губительным последствиям для всего живого приводит загрязнение морей нефтью, показала гибель танкера «Торри Каньон», когда у берегов Корнуэлла погибло более 40 тыс. птиц, на многие километры были испорчены устричные поля и пляжи.
Эти примеры показывают, насколько острой стала проблема уничтожения нефтяных отходов. Химическая очистка нецелесообразна, так как приводит к накоплению еще более ядовитых соединений. Адсорбционные методы очистки также неэффективны из-за недостаточно глубокой очистки и трудности регенерации ионитов.
Наиболее перспективным является микробиологическое разрушение углеводородов нефти, приводящее к превращению их в нетоксичные кислородсодержащие вещества. Так, например, используя культуры активных парафинокисляющих микобактерий, можно во многих случаях предотвратить загрязнение биосферы нефтепродуктами. Такие культуры, как Mycobact. paraffinicum и Mycobact. lacticolum var. aliphaticum, прекрасно разлагают многие образцы нефти.
Учитывая имеющиеся данные о биосинтезе парафинокисляющими микроорганизмами витаминов, аминокислот, каротиноидов и других полезных метаболитов, можно предположить, что клеточная масса культур, разлагающих нефтяные отходы, может быть использована и в качестве удобрения. Микобактерий нашли применение также как активные продуценты аминокислот (см. также стр. 443). Наиболее широкое использование с целью получения глютаминовой кислоты получил вид Mycobact. glutamicum. Выделены также микобактерий, продуцирующие 1-валин.
Род микококки (MYCOCOCCUS)
Микококки — кокковые формы микроорганизмов, родственные актиномицетам; занимают промежуточное положение между микобакте-риями и микрококками, отличаются от микобактерий отсутствием палочковидной стадии развития, а от микрококков — неравномерным характером роста и деления клеток. В микробиологии существуют некоторые роды микроорганизмов, окруженные таинственным ореолом: со времени их первого описания не появлялось больше сведений о культурах этого рода, их не выделяли и не описывали заново, и многие микробиологи начинали даже сомневаться в существовании этих микроорганизмов в природе. К таким «таинственным» организмам относятся представители рода Мусоcoccus.
Впервые микококки были описаны Н. А. Кра-сильыиковым в 1938 г. По внешнему виду колоний и общей микроскопической картине микококки не отличались от микрококков, и только при более детальном изучении морфологии и цикла развития выяснилось, что микококки имеют специфические особенности, не свойственные микрококкам и сближающие их с представителями лучистых грибков.
Согласно описанию рода Mycococcus особенности эти состоят в следующем:
1. Клетки, как правило, в молодых культуpax имеют неправильные очертания, они могут быть угловатыми, неправильно шаровидными, овальными, картофелевидными, сдавленными с одной или нескольких сторон; палочковидные клетки обнаруживаются очень редко, и их длина не превышает двойной поперечник клетки.
2. В одной и той же культуре клетки резко отличаются друг от друга по величине.
3. Размножаются клетки не только делением, но и почкованием.
4. В старых культурах обнаруживаются покоящиеся формы — крупные клетки, резко преломляющие свет; такие клетки прорастают подобно спорам актиномицетов с образованием 1—3 ростовых трубок.
Процессы почкования и прорастания покоящихся форм свидетельствуют, по мнению Н. А. Красильникова, о родстве микококков с лучистыми грибками. О близости микококков к ветвящимся бактериям (коринеформам) впоследствии писали и другие авторы. Предположение о генетическом родстве микококков с лучистыми грибками, сделанное Красильни-ковым на основании сравнения циклов развития, было окончательно доказано им в процессе наблюдения за расщеплением культур микококков с образованием микобактериальных форм.
Многие культуры микококков в эволюционном развитии потеряли признаки, сближающие их с лучистыми грибками, поэтому только в процессе расщепления можно было опознать действительную природу организмов (Красиль-ников, 1938). Микобактериальные (палочковидные) формы появлялись чаще в старых культурах на очень богатых или очень бедных средах, предпочтительно жидких. Повышенная концентрация NaCl в среде также стимулировала процесс расщепления. Факт образования микобактериальных рас у микококков свидетельствовал, по мнению Красильникова, о том, что микококки произошли когда-то от микобактерий и в ходе исторического развития деградировали и приняли наиболее упрощенную форму, напоминающую микрококки.
Таким образом, микококки являются как бы связующим звеном между микобактериями и микрококками.
Микрококки рассматриваются Красильниковым как организмы, филогенетически связанные с лучистыми грибками, и включены им, как и микококки, в класс Actinomycetes (Красильников, 1949).
В отношении физиолого-биохимических свойств культуры микококков не обнаружили каких-либо особых свойств. Они хорошо росли как на синтетических средах с минеральным азотом, так и на белковых средах при рН 5—9; их ферментативная активность была выражена слабее, чем у микобактерий и проактиномице-тов; многие виды микококков могли расти при 7 —12% NaCl в среде и были устойчивы к высушиванию. Было описано 10 видов рода Мусосос-cus, выделенных из почв и различающихся по пигментации и культурально-физиологическим признакам. При описании рода отмечалось, что микококки реже встречаются в почве, чем микобактерий или микрококки (Красильников, 1938).
Со времени первого описания рода в течение 30 лет в печати, как в советской, так и в зарубежной, не появлялось больше сообщений о микококках. В каждое новое издание определителя Берги переписывалось без всяких изменений описание рода Mycococcus, данное Н. А. Красильниковым в 1938 г. Типовые культуры микококков не сохранились, неотиповые культуры не были предложены. Поскольку описание рода Arthrobacter (Bergey, 1957) близко к описанию рода Mycococcus (Красильников, 1949), а новых работ, характеризующих микококки, нет, то высказывалась мысль о пересмотре законности существования этого рода. Ваксман предположил, что микококки представляют собой скорее мутанты или штаммовые варианты Actinomycetales, чем истинный вид или род.
Лишь в самые последние годы появилось несколько работ, в которых сообщается о новом выделении культур, близких описанию рода Mycococcus. Из организма человека были выделены кокки, образующие значительные количества перекиси водорода и определенные как микококки. В описании морфологии этих организмов сообщалось о размножении их путем деления и почкования. Поскольку по физиолого-биохимическим свойствам исследуемые кокки несколько отличались от всех известных видов Mycococcus и образовывали значительные количества перекиси водорода, было предложено выделить их в новый вид — Mycococcus hyperoxidans.
Рис. 108. Клетки мпкококков в световом микроскопе: 1—3 — варьирование размеров и очертаний клеток, фазовый контраст; 4 — образование конгломератов неопределенной конфигурации; 5 — «почкующиеся» клетки микококков; 6—7 — дробление клеток в конгломератах. Окраска клеточной стенки по Гутштейну. Увел. X 3600.
Из почв и ризосферы сельскохозяйственных растений Украины была выделена группа олигонитрофильных штаммов кокков, близких по систематическому положению к Mycococcus albus, но отличающихся от описания этого вида способностью к фиксации азота. По этому признаку микококки были выделены в новую разновидность — Mycococcus albus var. oligonitrofilus.
Морфологически описываемые культуры соответствовали описанию рода Mycococcus, форма клеток менялась от шаровидной и овальной до веретеновидной и лимоновидной; встречались ответвления и боковые выросты на клетках; наблюдалось варьирование в размерах клеток. Из рубцового отдела желудка коровы была выделена термотолерантная кокковидная культура, активно растущая на средах с парафинами. На основании изучения морфологических признаков культура была отнесена к роду Mycococcus. Авторы отмечали полиморфизм клеток в культуре этого организма и размножение путем деления, перешнуровывания и почкования, свойственного микококкам по описанию. По культурально-физиологическим признакам исследуемый организм был близок к виду Mycococcus lactis (Красильников, 1949), но отличался от описания этого вида повышенным температурным оптимумом роста (38— 43 °С) и способностью активно расти на средах с парафинами, выделяя при этом флавины.
При исследовании микрофлоры ризосферы в числе прочих микроорганизмов была выделена культура, соответствующая по морфологии микококкам и отнесенная к виду Mycoccocus lactis. При изучении микрофлоры литофильных (растущих на камнях) лишайников, покрывающих горы Памира и Тянь-Шаня, было обнаружено, что характерными компонентами литайниковых ценозов этих высокогорных районов являются пигментные кокковидные формы микроорганизмов. Среди последних были найдены и микококки.
Морфология и тонкое строение микококков
Клетки микококков значительно варьируют по величине (от 0,5 до 3—4 мкм) в одной и той же культуре, имеют разнообразную форму — шаровидную, овальную, клиновидную, треугольную, часто они как бы сдавлены с одной или нескольких сторон (рис. 108).
На ранних стадиях развития кокки собраны в конгломераты неопределенных конфигураций либо искривленные цепочки (рис. 108,4). Встречаются сочетания мелкой и крупной клеток, соединенных вместе, либо двух мелких клеток, прикрепленных с обеих сторон к большой клетке, что напоминает материнскую клетку с почками.
При окраске клеточных стенок кокков обнаружилось, что (рис. 108,5) крупные клетки (2—4 мкм), принимаемые в фазовом контрасте за единичные, представляют на самом деле конгломераты клеток, объединенных общей оболочкой. Внутри такой клетки-колонии видны беспорядочно расположенные перегородки (рис. 108, 6, 7).
Длительное непрерывное наблюдение за развитием культур дало возможность выявить определенный цикл развития. В первые часы роста образуются макроформы, представляющие агрегаты клеток, объединенные общей оболочкой. В последующем эти образования распадаются на отдельные клетки различной формы и величины. При этом на всех стадиях развития наблюдается неравномерный характер роста и деления (дробления) клеток. Даже шаровидные мелкие клеточки, образующиеся на конечных этапах дробления, приобретают перед каждым последующим делением треугольную форму, напоминая первые этапы прорастания спор актиномицетов тремя проростками.
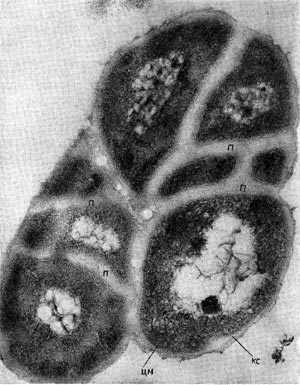
Рис. 109. Ультратонкий срез клеток Mycococcus species, демонстрирующий специфический способ деления микококков. Увел. X 60 000. п — перегородки; цм — цитоплазматическая мембрана; кс — клеточная стенка.
У некоторых штаммов с красно-розовой пигментацией культур обнаруживаются подвижные клетки. Они появляются при окончательном разделении конгломератов на единичные клеточки и имеют всегда правильно шаровидную форму. Подвижность сохраняется в 7 — 8-суточных культурах. Постоянное нахождение в препаратах исследуемых штаммов «почкующихся» клеток позволило предположить размножение этих организмов почкованием, что свойственно, по описанию, микококкам. Однако в результате наблюдения за развитием отдельных клеток в камере было показано, что микококки размножаются путем неправильного дробления, а не почкования.
Появление сочетаний клеток, похожих на материнские клетки с почками, оказалось результатом специфического неравномерного роста и деления исследуемых организмов.
Из всех известных кокковых форм неравномерный характер роста и деления описан только у клеток кокковидной стадии развития микобактерий. Как и для описываемых культур, для них характерен такой же неравномерный рост кокков, приводящий к формированию клиновидных клеток, и расположение перегородок под углом друг к другу, сопровождающееся образованием искривленных цепочек или неправильных скоплений клеток. Однако кокковидные клетки микобактерий при перенесении в свежую среду прорастают в палочки, в то время как у исследуемых культур палочковидная стадия развития не появлялась ни при каких условиях культивирования.
Клетки микококков имеют все характерные для прокариотных микоорганизмов структуры: клеточную стенку, цитоплазматическую мембрану, цитоплазму, содержащую различные включения, внутрицитоплазматические мембранные структуры и нуклеоид. Клеточные стенки имеют строение, характерное для грам-положительных организмов. Они состоят из двух электронно-плотных слоев и более широкого светлого слоя между ними (рис. 109 и 110). У некоторых штаммов отдельные участки клеточной стенки были сильно утолщены и имеют рыхлое, аморфное строение. Цитоплазма обычно мелкогранулярная и состоит из плотно упакованных рибосом. Внутри цитоплазматиче-ские мембранные системы трубчатого, ламелярного, а у некоторых штаммов и везикулярного типа. Нуклеоид занимает участки различных размеров и форм и имеет фибриллярное строение.
Изучение тонкого строения микококков дало возможность наблюдать необычный для кокков способ деления, предполагаемый при исследовании культур в световом микроскопе. Оказалось, что всем представителям микококков свойственно неравномерное, неправильное деление (дробление) клеток на несколько частей.
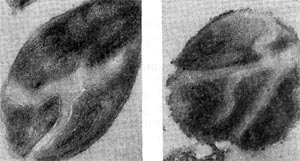
Рис. 110. Ультратонкие срезы микококков (Mycococcus species). Видно дробление клеток. Увел. X 30 000.
Перегородки закладываются сразу в нескольких участках клеточной стенки без какой-либо закономерности и растут центрипетально, дробя клетку на секции разной величины и формы (рис. 109 и 110). В одной клетке может образоваться от трех до десяти перегородок, а их беспорядочное расположение обусловливает образование причудливо расчлененной крупной клетки-колонии. Каждая клеточка в такой клетке-колонии имеет свою мембрану и внутренний слой клеточной стенки. Внешний слой клеточной стенки является общим для всех клеточек и при отделении их друг от друга, по-видимому, формируется заново.
Иногда септы (перегородки) могут располагаться параллельно друг другу; в других случаях они отчленяют краевые участки клетки, имеющие серповидную или треугольную форму. Встречается и радиальное расположение перегородок. Со временем крупная клетка-колония дробится на отдельные части по этим перегородкам, распадаясь на все меньшие и меньшие агрегаты клеток неопределенной конфигурации.
Неравномерное деление (дробление) клеток было обнаружено у некоторых представителей класса лучистых грибков. Таким образом, размножение микроорганизмов путем неравномерного деления свойственно некоторым культурам кокков и актиномицетов, включая и микококки.
Физиолого-биохимические особенности микококков
Микококки являются аэробными гетеротрофными, грамположительными организмами, растущими при температуре от 10 до 30 °С и обладающими слабой ферментативной активностью. Культуры микококков, выделяемые из почв, хорошо растут на синтетических средах с минеральным источником азота. Микококки, обитающие в лишайниках, требуют при культивировании аминокислот и витаминов в качестве ростовых факторов, что связано, по-видимому, с их экологией.
Представители рода Mycococcus, выделяемые из почв и лишайников, большей частью окрашены в красные, розовые и желтые тона за счет внутриклеточных пигментов, образуемых этими культурами. Изучение физико-химических свойств пигментов показало, что они относятся к группе кислородсодержащих кароти-ноидов.
Культуры микококков, выделяемые из организма человека и животных, как правило, беспигментные.На микококках из литофильных лишайников впервые было проведено определение нуклео-тидного состава ДНК рода Mycococcus. Оказалось, что содержание ГЦ пар в ДНК у представителей рода Mycococcus колеблется от 62,3 до 69,4 мол.%. Если учесть, что содержание ГЦ в ДНК различных родов класса актино-мицетов колеблется от 62 до 78 мол.%, то по этому признаку род Mycococcus оказался близким к лучистым грибкам. Род Micrococcus характеризуется также близкой величиной нуклеотидного состава (57—75 мол.% ГЦ).
В клеточных стенках микококков в качестве основных аминокислот был обнаружен лизин в сочетании с аспарагиновой кислотой и глицином, а из Сахаров — галактоза и арабиноза. Учитывая одновременно морфологические особенности и химический состав клеточных стенок, можно сказать, что в близком родстве с ми-кококками находятся микрококки и микобак-терии. Это подтвердилось и данными инфракрасной спектроскопии. Интересным явилось обнаружение у микококков фермента поли-фосфатглюкокиназы. Этот фермент был найден лишь у представителей класса актиномицетов и не был обнаружен ни у истинных бактерий, ни у водорослей. Присутствие полифосфатглюкокиназы в культурах микококков еще раз доказывает их родство с лучистыми грибками, установленное Н. А. Красильниковым на основании морфологии и изменчивости культур микококков.
Изучение морфологии, тонкого строения и биохимических особенностей микококков с помощью современных методов исследования позволило выявить новые, ранее не описанные свойства. В связи с этим в настоящее время внесены следующие дополнения в диагноз рода Mycococcus. Клетки микококков сферические, но имеют неправильные, угловатые очертания; размеры клеток в одной и той же культуре варьируют от 0,5 до 3—4 мкм. Большей частью коккоиды собраны в агрегаты неопределенной конфигурации или искривленные цепочки.
Палочковидная стадия развития отсутствует. Клеткам микококков свойствен неравномерный характер роста. Размножение происходит путем неравномерного деления (дробления) клетки на несколько частей. Встречаются подвижные формы, имеющие всегда правильно шаровидную форму клеток. По внешнему виду колоний культуры микококков не отличаются от культур микобактерий или микрококков. По Граму, окрашиваются положительно, аэробы. Нуклеотидный состав ДНК колеблется от 62 до 69 мол.% ГЦ. Пигменты окрашенных форм относятся к группе кислородсодержащих каротиноидов. Клеточные стенки содержат лизин, аспарагиновую кислоту, глицин, а из Сахаров — арабинозу и галактозу.
Экология микококков и их значение в природе и жизни человека
В настоящее время имеется весьма небольшое число сведений о распространении микококков. Известно, что микококки были выделены из почв, лишайников, ризосферы и листьев растений, из организма человека и животных. Из этого следует, что, по-видимому, они довольно широко распространены в природе. При изучении состава почвенной микрофлоры, возможно, их путали с микрококками. Выделенные из ризосферы сельскохозяйственных растений микококки фиксировали азот атмосферы в довольно значительных количествах, участвуя тем самым в снабжении азотом растений наряду с другими азотфиксаторами.
Обитающие в литофильных лишайниках микококки оказались способными, как и сами лишайники, к поглощению и аккумуляции в клетках радиоактивных веществ. Особый интерес представляют микококки, выделенные из организма человека и животных и образующие перекись водорода (Н202). Сотрудниками кафедры микробиологии Днепропетровского медицинского института было показано, что микококки — продуценты H202 — часто выделяются из тканей новообразований и из органов животных, облученных рентгеном. Облучение, столь важное в терапии рака, может быть, по-видимому, полностью заменено воздействием эквивалентного количества перекиси водорода, поскольку действие облучения состоит лишь в том, что оно вызывает образование H202. Предполагается, что попадание продуцентов Н2О2 в ткань новообразований имеет в своей основе защитный механизм.
Порядок кокки (COCCALES)
Название «кокки» было предложено для бактерий, имеющих сферическую форму клетки (от греч. «коккус» — ягода). Человек, сам того не подозревая, постоянно сталкивается в своей жизни с кокковидными микроорганизмами. Кокки находятся в воздухе, которым мы дышим, в земле, по которой мы ходим, в цветах, которые мы собираем, в воде рек и морей, в пище, которую мы едим, и даже в нашем организме. Одни виды кокков полезны для человека — их используют в производстве молочных продуктов (кефира, масла, сыров), при приготовлении силоса; они участвуют в круговороте веществ в природе, разлагая различные отмершие остатки растений и животных и выполняя тем самым роль «мусорщиков»; они стимулируют рост культурных растений, снабжая их витаминами и гетероауксинами. Другие виды кокков издавна наносили большой вред человеку, являясь источником заражения и нагноения ран, вызывая такие тяжелые заболевания, как крупозная пневмония, менингит, гоноррея и др. Развиваясь в некоторых молочных, мясных и рыбных продуктах, некоторые кокки выделяют в среду сильнейший яд — энтеротоксин — и вызывают тем самым пищевые отравления людей.
Рис. 111. Родовая принадлежность кокков в зависимости от расположения клеток после деления: 1 — Micrococcus; 2 — Streptococcus; 3 — Gaffkya; 4 — Sarcina; 5 — Diplococcus.
Если посеять пробы воды, почвы, кусочки растений, слюну, гной людей или животных, зараженных патогенными кокками, на специальные твердые питательные среды, мы увидим разнообразные колонии. У патогенных кокков колонии, как правило, невзрачные (мелкие и бесцветные); у сапрофитных форм часто обнаруживаются красивые колонии, окрашенные в яркие красные, розовые, оранжевые и синие тона. Особенно много пигментных форм кокков в воздухе, на поверхности высших растений и литофильных (растущих на камнях) лишайников, т. е. там, где они подвержены действию солнечной радиации. Предполагают, что пигменты, вырабатываемые микроорганизмами, выполняют защитные функции.
Сапрофитные формы кокков довольно неприхотливы: они растут в широком диапазоне температур (от 10 до 45 °С), развиваются на обычных пептонных средах, некоторые виды обитают в местах с повышенными концентрациями солей, другие устойчивы к радиоактивному излучению. Обитающие в организме человека кокки адаптировались к паразитическому образу жизни и трудно поддаются культивированию, требуя особых условий влажности, температуры, сложных питательных веществ.
Если посмотреть под микроскопом, мы увидим, что колонии кокков состоят из множества мелких округлых клеточек. Величина их может варьировать от 0,2 до 2,5—3 мкм, но чаще всего встречаются клетки от 0,5 до 1 мкм. Изучать такие мелкие организмы в световом микроскопе довольно сложно. Несмотря на то что само название «кокки» предполагает сферическую форму клетки, у некоторых кокков клетки имеют несколько удлиненную, ланцетовидную форму (у «молочных» стрептококков) или форму кофейных зерен (у гонококков). Цикл развития кокков крайне прост: клетка делится на две равные кокковидные клетки. Такой простой жизненный цикл осложняет систематизацию кокковых форм, к тому же почти все кокки (за небольшим исключением) неподвижны, не образуют спор, большей частью грамположи-тельны.
Какие же признаки могут служить дифференцирующими при разделении кокков на таксоны? Оказалось, что в зависимости от того, в какой плоскости происходит деление клетки, кокки располагаются после деления либо в виде цепочек, либо тетрад, либо пакетов или скоплений неправильной формы.
Еще в 1900 г. Мигула разделил кокки на 5 родов на основании способа деления, а также подвижности:
Streptococcus — цепочки кокков, деление в одной плоскости;
Micrococcus — одиночные или в неправильных скоплениях кокки;
Sarcina — правильные пакеты, деление в трех взаимно перпендикулярных направлениях;
Planosarcina и Planococcus — подвижные сарцины и микрококки.
До сих пор во всех современных учебниках и руководствах по микробиологии приводятся традиционные рисунки различных сочетаний кокковидных клеток, характеризующих определенный род (рис. 111).
В широко используемом в нашей стране «Определителе бактерий и актиномицетов» Н. А. Красильникова все кокки, объединенные в одно семейство Соссасеае (порядок Соссасеае, класс Actinomycetes), подразделяются на роды по следующим признакам: клетки одиночные — род Micrococcus, клетки соединены в пары — род Diplococcus, в цепочки — род Streptococcus, в пакеты — род Sarcina. Таким образом, видно, что распределение по родам основано на том же морфологическом, легко обнаруживаемом признаке. Роды Neisseria и Nitroso-coccus, также включенные Н. А. Красильнико-вым в семейство Соссасеае, выделяются по другим свойствам — окраске по Граму и автотрофному типу питания соответственно.
В настоящее время известно свыше 15 родов кокков. Некоторые роды — Gaffkya, Pediococcus, Staphylococcus — были описаны очень давно, но считались ранее синонимами рода Micrococcus. Род Leuconostoc рассматривался Н. А. Красильниковым как вид, входящий в род Streptococcus. При увеличении количества родов семейства Соссасеае одного морфологического признака оказалось недостаточно для дифференциации кокковых форм, поэтому стали использоваться в качестве диагностических такие признаки, как окраска по Граму, отношение к кислороду, тип метаболизма, патогенность и др. Многие авторы предлагают выделять уже не одно, а несколько семейств кокков. Так, в определителе бактерий Берги кокки распределены по трем семействам: Micrococcaceae, Neisseriaceae и Lactobacillaceae — триба Streptococcaceae. Род Nitrosococcus помещен в семейство Nitrobacteriaceae.
Ниже мы приводим краткую характеристику основных родов кокков.
Роды диплококки (DIPLOCOCCUS), стрептококки (STREPTOCOCCUS), педиококки (PEDIOCOCCUS), леиконосток (LEUCONOSTOC), пептострептококки (PEPTOSTREPTOCOCCUS)
Эти роды объединены по определителю бактерий Берги в трибу Streptococcaceae, семейство Lactobacillaceae. Общие признаки перечисленных выше родов: грамположительные, образуют цепочки, неподвижные, кокки, микроаэрофилы или факультативные анаэробы, каталазу не образуют, энергетический метаболизм протекает по типу брожения, нуждаются в сложных питательных веществах. Род Streptococcus. Этот род включает в себя:
1) пиогенные (гноеродные) стрептококки — патогенные для человека и животных;
2) фекальные стрептококки
и 3) безвредные «молочные» стрептококки.
Пиогенные стрептококки адаптированы к паразитическому образу жизни в организме млекопитающих. Их выращивают при 37 °С в бульоне с сывороткой и кровью в атмосфере, содержащей 5—10% С02. Типичный представитель группы пиогенных стрептококков — Str. pyogenes. Здесь и далее родовое название видов Streptococcus дается сокращенно Str. Он служит возбудителем скарлатины, ангины, послеродового сепсиса и других тяжелых эпидемических инфекций человека. Str. agalactiae вызывает в основном инфекции у крупного рогатого скота.
Фекальные стрептококки обнаруживаются в испражнениях человека и животных. Некоторые из них постоянно живут также в полости рта, откуда и попадают в кишечник. Str. salivarius встречается в основном у человека; Str. bovis — только у рогатого скота; Str. equinus — у лошадей и других животных.
В эту же группу входят более устойчивые энтерококки, обнаруживаемые в кишечнике человека и животных, навозе, молочных продуктах. Они часто образуют скопления, напоминающие скопления микрококков. Типичный представитель энтерококков — Str. faeca-lis. Все энтерококки хорошо растут при температуре 22—40 °С на обычных мясных средах. Поскольку фекальные стрептококки постоянно присутствуют в кишечнике человека, сохраняют жизнеспособность во внешней среде, легко культивируются и идентифицируются, их принято считать индикаторами фекального загрязнения.
Стрептококки «молочной» группы вызывают скисание молока и играют важную роль в молочной и пищевой промышленности. Они быстро растут в молоке при 28 °С, вызывая его свертывание. Типичные представители «молочных» стрептококков — Str. lactis, Str. cre-moris и Str. thermophilus. Последний выдерживает температуру 63 °C и используется для получения сыров, которые готовят при относительно высокой температуре.
Род Diplococcus
К этому роду относится единственный вид — Diplococcus pneumoniae, вызывающий крупозную пневмонию и другие тяжелые инфекции — менингит, септицемию, перитонит.
Диплококки содержатся в слюне и мокроте больных крупозной пневмонией, обнаруживаются также в полости рта и носоглотке здоровых людей. Культивируются они так же, как и пиогенные стрептококки.
Род Leuconostoc
Название микроорганизмов этого рода происходит от названия сине-зеленых водорослей — Nostoc и от греческого слова «лейкос» — бесцветный. Бактерии рода Leuconostoc напоминают водоросли Nostoc тем, что образуют переплетающиеся цепочки, состоящие из сферических клеток, окруженных толстой капсулой, но лишены хлорофилла в отличие от водорослей. Представители рода Leuconostoc относятся к гетероферментативным микроорганизмам. L. mesenteroides и L. dextranicum сбраживают квашеную капусту, силос и соки в процессе производства сахара. Они наносят ущерб сахарной промышленности, образуя слизи и камеди, засоряющие чаны и трубопроводы.
L. citrovorum в сочетании со Str. lactis и Str. cremoris добавляют к молоку и сливкам, идущим на производство масла и сыра, так как этот организм расщепляет лимонную кислоту с образованием диацетила, придающего приятный вкус сливочным маслам.
Род Peptostreptococcus
Клетки в парах или цепочках, неподвижны, грамположительны. Анаэробы. Разрушают различные вещества, содержащие протеины, органические кислоты и углеводы с образованием СО2, Н2 и других продуктов. Обнаруживаются в дыхательных путях и пищеварительном тракте человека и животных. Встречаются патогенные виды. Типовой вид — Peptostreptococcus anaerobius, выделяется он из гангренозных очагов, аппендикса, крови.
Род Pediococcus
К этому роду относятся гетероферментативные микроаэрофильные кокки. Поскольку они часто образуют скопления кубовидной формы наряду с цепочками кокков, их называли иногда сарцинами.
Педиококки развиваются в бродящих растительных продуктах, главным образом в пиве и пивном сусле. Пиво скисает и мутнеет, приобретает неприятный вкус и запах. Типовой вид — Pediococcus serevisiae.
Роды микорококки (MICROCOCCUS), стафилококки (STAPHYLOCOCCUS), гафуия (GAFFKYA), сарцины (SARCINA), метанококки (METHANOCOCCUS), пептококки (PEPTOCOCQJS)
Эти роды объединяются в семейство Micro-соссасеае по определителю Берги.
Общие признаки вышеперечисленных родов: грамположительные, большей частью свободно-живущие сапрофитные кокки с правильно сферической формой клеток. За исключением Peptococcus, все они растут в широком диапазоне температур (22—40°С), в самых разнообразных условиях: в инфицированных тканях, грязи, молочных и мясных продуктах, в почве, пыли, воздухе, морской и речной воде, на поверхности растений. Все они гетеротрофы и хорошо растут на обычных пептонных средах. Много встречается окрашенных форм.
Род Micrococcus
Клетки в неправильных скоплениях, у некоторых видов наблюдаются подвижные клетки. Одни виды бесцветные; другие образуют пигмент оранжевого, желтого или красного цвета. Сапрофиты или факультативные паразиты, патогенных видов нет. У большинства видов оптимум температуры 25—30 °С, хотя для Micr. cryophilus оптимальная температура -|-100С. Большинство микрококков довольно устойчивы к высушиванию и нагреванию; Некоторые виды (Micr. morrhuae и Micr. halodenitrificans) галофильны и могут расти в среде, содержащей до 20—30% NaCl. Распространены повсеместно — в почве, воздухе, воде, пищевых продуктах. Разлагая органические остатки, содержащие белки, с образованием аммония, микрококки выполняют тем самым роль «мусорщиков». Micr. ureae разлагает мочевину до аммонийных солей, a Micr. colpogenes, обитающий в морской воде, разрушает хитин. Виды Micr. denitrificans и Micr. halodenitrificans редуцируют нитраты и нитриты до свободного азота, участвуя в круговороте азота в природе. Типовой вид рода — Micr. luteus.
Род Staphylococcus
Представители этого рода отличаются от микрококков тем, что являются факультативными анаэробами и вызывают ферментацию глюкозы в анаэробных условиях с образованием кислоты, кроме того, многие виды стафилококков патогенны. Большинство видов требуют органических источников азота и витаминов для роста. Многие штаммы образуют оранжевый или желтый пигмент. Типовой вид рода — Staphylococcus aureus. Staphylococcus aureus — возбудитель гнойных инфекций, он может вызывать маститы, фурункулезы, абсцессы внутренних органов. Staphylococcus epidermidis — менее вирулентный возбудитель тех же инфекций.
Стафилококки нередко вызывают пищевые отравления, что связано с их способностью вырабатывать яды — энтеротоксины. При попадании токсинов в желудочно-кишечный тракт возникают тошнота, рвота, понос.
Встречаются чаще всего на коже и слизистых теплокровных животных, в различных пищевых продуктах, воздухе. Сапрофитные стафилококки трудно отличить от микрококков.
Род Gaffkya
Представители этого рода характеризуются тем, что образуют тетрады клеток, часто окружены толстыми капсулами. Аэробы и факультативные анаэробы. Оптимум температуры 37 °С. Патогенны для мышей и некоторых других животных. Типовой вид — Gaffkya tetragena.
Род Sarcina
Деление клеток в трех взаимно перпендикулярных направлениях обусловливает образование правильных пакетов кокков, характерных для представителей этого рода. Следует отметить, что род этот весьма гетерогенный. В него входят как неподвижные, так и подвижные виды (Sarcina ureae), как аэробные, так и облигатно анаэробные виды. В связи с этим род Sarcina подразделяется на подроды:
1. Подрод Zymosarcina — микроаэрофилы или анаэробы, используют сахара, не образуют метан. Сюда входят виды Sarcina ventriculii и Sarcina maxima. Интересно, что пакеты Sarcina ventriculii склеены веществом, состоящим из целлюлозы, выделяемой клетками этого вида.
2. Подрод Methanosarcina — анаэробы, не используют Сахаров, образуют метан из CО2. Сюда относятся виды Sarcina methanica и Sarcina barkeri.
3. Подрод Sarcinococcus — аэробы, не превращают мочевину в аммонийные соли. Сюда входят наиболее часто встречающиеся в воздухе, воде и почве виды: Sarcina lutea, Sarcina flava (желтый пигмент), Sarcina auran-tiaca (оранжевый) и Sarcina litoralis (красный пигмент) — галофильный вид.
4. Подрод Urosarcina — аэробы, превращают мочевину в аммонийные соли. Представитель этого подрода — Sarcina urea — интересен тем, что образует эндоспоры. Последние локализуются в центре клетки. Кроме того, клетки этого вида подвижны и имеют по одному длинному жгутику. Все виды сарцин относятся к сапрофитам или факультативным паразитам. Как и микрококки, они участвуют в круговороте веществ в природе.
Род Methanococcus
Клетки единичные, в парах или агрегатах. Подвижны или неподвижны. Грамвариабильны. Отличительный признак рода — разложение различных органических соединений с образованием метана. Анаэробы. Сапрофиты. Типовой вид — Methanococcus mazei. Метанококки обитают в болотах и отстоях сточных вод, образуют метан (болотный газ), СО-2, а иногда и водород.
Род Peptococcus
Клетки единичные, в парах, тетрадах, агрегатах. Неподвижные, грам-положительны. Облигатные анаэробы, обладающие протеолитической активностью и ферментирующие разнообразные органические соединения. Оптимум температуры 37 °С. Типовой вид — Peptococcus niger, образующий пигмент черного цвета. Обитают в испражнениях, грязи, в человеческом организме и способны при определенных условиях вызывать септические инфекции.
Роды нейссерия (NEISSERIA) и веилонелла (VEILLONELLA)
По определителю Берги эти роды объединяются в семейство Neisseriaceae. Грамотрицательные неподвижные кокки, большей частью паразиты человека, оптимум температуры 37 °С.
Neisseria
Neisseria — мелкие аэробные диплококки, напоминают по форме кофейные зерна. Микроорганизмы этого рода — классический пример хрупких бактерий, высокоадаптированных к паразитическому образу жизни. Они не могут долго сохраняться вне организма, при высушивании погибают, растут лишь на мясной среде с кровью при высокой влажности, температуре 35—37 °С, в атмосфере, содержащей 5—10% С02.
В отличие от широко распространенных представителей Micrococcaceae, Neisseria обнаруживаются лишь в верхних дыхательных путях человека. Исключение составляет N. gonorr-haeae (гонококки) — возбудитель гонорреи, размножающийся в мочеполовом тракте. N. meningitidis (менингококки) вызывает эпидемический цереброспинальный менингит.
Существуют и сапрофитные представители Neisseria — N. flava, N. catarrhalis и N. sicca. Они развиваются в организме млекопитающих, но безвредны.
Род Veillonella
Род Veillonella — грамотрицательные анаэробные кокки, обитающие в полости рта здоровых людей и животных. Изучены мало. Сравнительно недавно описаны два рода кокков, еще не вошедшие в определители.
Род Aerococcus
Род Aerococcus — кокки, обычно загрязняющие воздух. Выделены в особый род на основании устойчивости к 40% желчи и кристалл-виолету. Выживают при 60 °С в течение 30 мин, растут только в щелочной среде при рН 9, грамположительны.
Род Methylococcus
Род Methylococcus — диплококки или цепочки кокков, грамотрицательны. В отличие от метанобразующих бактерий приставка Methyl обозначает — метанокисляющие. Кроме метана, культуры этого рода могут использовать и метанол. Предполагается выделить этот род вместе с другими метанокисляющими бактериями в отдельное семейство — Methylobacteriaceae.
Новые подходы к таксономии Соссасеае
В настоящее время большинство исследований по систематике кокков касаются наиболее широко распространенных в природе представителей родов Micrococcus, Staphylococcus и Sarcina. Стафилококков постоянно выделяют из организма человека и животных, воздуха, различных пищевых продуктов; микрококков и сардин — из почвы, воздуха, воды, растений.
Начиная с конца прошлого столетия и до настоящего времени ведутся постоянные поиски признаков, которые бы дали возможность четко разграничить два больших рода — Micrococ-cus и Staphylococcus, представляющих яркий пример дихотомии в бактериальной классификации. В качестве дифференцирующих родовых признаков использовались самые разнообразные свойства — патогенность, термоустойчивость, антигенный состав, чувствительность к антибиотикам. Многие исследователи пытались, наоборот, объединить роды Staphylococcus и Micrococcus в один род и производить лишь деление на виды.
Большой вклад в систематику кокков внес английский микробиолог Бэрд Паркер, исследовавший свыше тысячи культур кокков, выделенных из самых разнообразных источников — почвы, воздуха, молока, поверхности растений, организма человека и животных. Первоначально все исследуемые культуры кокков были отнесены им к трем родам — Staphylococcus, Micrococcus и Sarcina; в свою очередь, каждый род был поделен на несколько групп на основании физиолого-биохимических особенностей. Все культуры были исследованы в сравнительном аспекте с использованием общепринятых методов, рекомендуемых для диагностики бактерий обществом американских бактериологов. Были введены и новые признаки для характеристики групп — химический состав клеточных стенок и чувствительность к лизоциму. Роды Staphylococcus и Micrococcus разграничивались на основании анаэробной ферментации глюкозы. Представители рода Staphylococcus способны в анаэробных условиях ферментировать глюкозу с образованием кислоты, в то время как культуры рода Micrococcus не обладают таким свойством. Использование этого теста для разграничения вышеуказанных родов было принято официально подкомитетом по таксономии Micrococcaceae в 1964 г. Принадлежность культур к роду Sarcina устанавливалась по способности кокков образовывать правильные пакеты клеток. Однако и Бэрд Паркер, и другие авторы отка-..зались от выделения аэробных пакетообразую-щих кокков в самостоятельный род Sarcina.
Исследования последних лет показали, что анаэробная ферментация глюкозы не является надежным признаком для дифференциации микрококков и стафилококков. Начались поиски новых тестов. Большие исследования проведены по изучению нуклеотидного состава ДНК кокков чешскими авторами (Коцур, Мартинек, Мазанек и др.). В результате удалось разграничить по этому признаку два больших рода — Micrococcus и Staphylococcus установлено, что у представителей рода Staphylococcus молярный процент ГЦ в ДНК колеблется от 30,7 до 36,4, в то время как у представителей рода Micrococcus — от 65 до 75. Впоследствии было предложено расширить предел колебаний величины ГЦ для рода Micrococcus от 57 до 75 мол. % . Культуры микрококков, у которых содержание ГЦ было значительно ниже предела, установленного для рода Micrococcus (39—51 мол. %), предложено выделить в особый род — Pianococcus.
Исследование состава оснований ДНК у сар-цин показало, что они не отличаются по нук-леотидному составу от представителей рода Micrococcus. Исследователи, изучавшие кокковые формы микроорганизмов, уже давно отмечали, что образование пакетов культурами аэробных кокков не является стабильным признаком: при определенных условиях культивирования аэробные сарцины теряют способность к образованию пакетов. Следовательно, пакетообразование не может служить ценным критерием для разделения родов Micrococcus и Sarcina. По физиологическим и культураль-ным признакам и нуклеотидному составу ДНК аэробные сарцины не отличаются от микрококков. На основании этого предложено аэробные пакетообразующие кокки исключить из рода Sarcina и перенести их в род Micrococcus. Родовое название Sarcina в таком случае сохраняется за анаэробными видами сарцин, стабильно образующими пакеты и имеющими в составе оснований ДНК 28—30 мол. % ГЦ. В последней сводке по нуклеотидному составу кокков даются пределы колебаний ГЦ для каждого рода кокков.

Оказалось, что с нуклеотидным составом ДНК коррелирует и содержание менахинонов. Менахиноны (витамины группы К), связанные с электронным транспортом у бактерий, были обнаружены у всех микрококков и стафилококков, но в разных количествах, от нескольних микрон до более чем 400 мкг. В менахинонах разных микроорганизмов может содержаться от 6 до 9 изопреновых единиц. Однако мена-хиноны, состоящие из 6 изопреновых единиц, были обнаружены только у представителей рода Micrococcus, в то время как микроорганизмы из рода Staphylococcus содержали мена-хиноны только с 9 изопреновыми единицами. Содержащие водород менахиноны были обнаружены только у пигментированных микрококков, характеризующихся наивысшим содержанием ГЦ.
Последнее время в качестве таксономического признака все чаще используется химический состав клеточных стенок микроорганизмов. Были сделаны попытки определить и сравнить химический состав клеточных стенок и у кокков. Характерной общей особенностью для микрококков и стафилококков является отсутствие диаминопимелиновой кислоты в клеточных стенках, вместо нее присутствует лизин. По мере продвижения от подгрупп рода Staphylococcus к подгруппам рода Micrococcus, выделенным Бэрд-Паркером, упрощается аминокислотный состав пептидов. Набор Сахаров, напротив, более полный у микрококков высших групп. Интересно, что в пептидогликанах клеточных стенок стафилококков присутствуют связи глицин-глицин, в то время как в пептидных цепочках культур рода Micrococcus такие мостики отсутствуют. Чувствительность культур рода Staphylococcus к антибиотику лизостафину объясняется воздействием этого антибиотика на глициновые мостики; микрококки же устойчивы к действию лизостафина. Таким образом, четкое разграничение родов Micrococcus и Staphylococcus становится все более вероятным на основании нуклеотидного состава ДНК, химического состава клеточных стенок, содержания менахинонов и других признаков современной таксономии.
Тонкое строение кокков. Способ деления
Принципиальное строение клеток кокков в целом не отличается от такового у других прокариотных микроорганизмов. Клетки кокков состоят из клеточной стенки, цитоплазма-тической мембраны, цитоплазмы с различными включениями и нуклеоида.
У кокков развиты внутрицитоплазматиче-ские мембранные структуры, имеющие разное строение — ламеллярное, трубчатое, везикулярное. Внутрицитоплазматические мембранные структуры (мезосомы) часто связаны с нуклеоидом или заключены в пего. Мезосомы находятся в контакте с растущими перегородками, и существует предположение, что они участвуют в делении клетки.
На основании строения клеточной стенки, а также ее химического состава все кокки, как и прочие бактерии, разделены на две большие группы — грамположительные и грамотрицательные. Известно, что у грамположительных бактерий клеточная стенка, как правило, толще, чем у грамотрицательных, хотя этот признак не стабилен. Например, стенки стрептококков становятся в 2—3 раза толще при добавлении к питательной среде хлорамфеникола, а клеточные стенки Staphylococcus aureus увеличиваются от 300 до 1000 А при выращивании на среде, содержащей 4,5% NaCl.
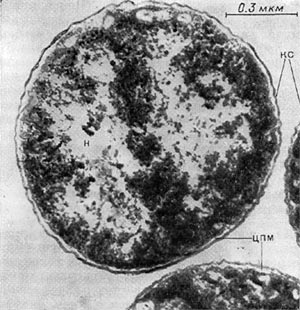
Рис. 112. Тонкое строение Neisseria catarrhalis. КС — клеточная стенка, ЦПМ — цитоплазматическая мембрана, Н — нуклеоид.
С помощью окраски уранилацетатом у грамположительных кокков проявляется довольно однородный плотный слой, иногда ограниченный более узкими электронно-плотными слоями с обеих сторон (рис. 2). Большую часть стенки этих организмов составляет муреин или пептидогликан, достигая у отдельных видов микрококков до 80— 90% от общей массы стенки. Это вещество придает стенке механическую прочность. Что касается других компонентов, то в клеточных стенках грамположительных кокков могут обнаруживаться различные тейхоевые кислоты, полисахариды и протеины. При изучении тонкого строения клеток различных кокков обнаружилось, что многие виды кокков, относимые ранее к роду Micrococcus (грамположительные кокки), по строению клеточной стенки оказались близки к грамотрица-тельным бактериям, и, следовательно, встает вопрос об исключении этих организмов из рода Micrococcus, а возможно, и из семейства Mic-rococcaceae. Так оказалось, что виды Micr. radiodurans, Micr. denitrificans, Micr. diversus, Micr. cryophilus имеют строение клеточной стенки, аналогичное таковому у грамотрицательных кокков рода Neisseria (рис. 112). Micrococcus radiodurans был описан как обычный грамположительный представитель рода Micrococcus, образующий тетрады и близкий к видам Micr. roseus и Micr. rubens tetragenus, отличающийся от них главным образом устойчивостью к радиации.
При изучении тонкого строения Micr. radiodurans было обнаружено, что клеточная стенка этого организма имеет сложное строение, характерное для грамотрицательных бактерий, и состоит из четырех слоев, каждый из которых имеет характерную тонкую структуру. Внешний мембранный волнистый слон напоминает таковой у сине-зеленых водорослей и участвует, по-видимому, в регулировании проницаемости. Часть этого слоя имеет хорошо выраженные участки гексагонально расположенных единиц. Мукопептидный слой пористый и имеет псевдогексагональное расположение пор. Определение химического состава клеточной стенки
Micr. radioclurans показало присутствие большого количества в ней липопротеинов и широкого набора аминокислота-характерного для грамотрицательных бактерий. Таким образом, и химический состав подтвердил принадлежность Micr. radiodurans к группе грамотрицательных кокков. Другой пример — исключение одного из видов кокков из семейства, к которому он был ранее отнесен, — Neisseria haemolysans. Строение клеточной стенки и способ деления этого организма оказались аналогичны таковым у грамположительных бактерий. Было предложено вид Neisseria haemolysans исключить из семейства грамотрицательных кокков Neis-seriaceae и отнести к семейству грамположительных организмов — Lactobacillaceae. В настоящее время на основании строения и химического состава клеточных стенок пересматривается таксономическое положение многих видов кокков. Наблюдается тенденция к сокращению числа видов микрококков. Так, кокки, называемые ранее Sarcina lutea, Micr. flavus, Micr. citreus, Micr. lysodeicticus, предлагается относить к одному виду — Micr. luteus.
Со строением клеточной стенки и цитоплазма-тической мембраны тесно связан и способ деления бактерий. Все грамположительные организмы делятся путем центрипетального врастания от краев к центру септ и последующего разделения клеток по этим перегородкам. До недавнего времени считали, что у грамотрицательных микроорганизмов деление происходит без образования перегородок путем постепенного впячивания всех слоев клеточной стенки внутрь с образованием перетяжки в центре клетки, которая становится все тоньше и тоньше и приводит к отделению клеток друг от друга. При определенных условиях фиксации клетки септы все же удалось обнаружить и у типичных грамотрицательных бактерий. Что касается кокков, то, к сожалению, в большинстве работ не описывается подробно способ деления. При просмотре фотографий срезов Micr. cryophilus, Micr. diversus, Neisseria sicca, Neisseria catarrhalis, Micr. denitrificans — организмов, имеющих строение клеточной стенки, типичное для грамотрицательных бактерий, видны перешнуровывающиеся при делении фигуры, а иногда одновременно и септы. Поскольку у истинных грамположительных бактерий не наблюдали перешнуровывания, нахождение такового у вышеописанных кокков служит, по-видимому, дополнительным подтверждением принадлежности этих культур к грамотрицательным бактериям.
Интересно исследование механизма клеточного деления у культуры грамвариабильного кокка. Этот кокк имеет типичное для грамотрицательных организмов строение клеточной стенки, но окраска по Граму была вариабиль-на. Химический же состав его клеточных стенок отличается от такового у грамотрицательных бактерий. Механизм клеточного деления заключается в образовании септы, состоящей из цитоплазматической мембраны и внутреннего слоя клеточной стенки. Внешняя мембрана при этом не втягивается вместе с внутренним слоем при образовании перегородки, а формируется заново при разделении клеток. Одновременно с образованием перегородки наблюдается и перешнуровывание. Исследователи, описавшие эту культуру, предложили такие грамвариабильные кокки, относимые ранее к микрококкам, поместить в отдельный род, промежуточный между истинными грамположительными и грамотрицательными бактериями.
В образовании перегородок перед делением возможны также различные варианты. Оказалось, что бактериальная клетка не всегда делится на две равные части с помощью одной септы; в ней могут одновременно закладываться несколько перегородок, делящих клетку на неравные части. Такой необычный способ деления был обнаружен у бластококка, метаносарцины, микококков, выделенных из литофильных лишайников. В результате беспорядочного деления клетки в разных плоскостях и благодаря тому, что клетки в течение длительного времени остаются соединенными вместе, образуются многоклеточные агрегаты неопределенных конфигураций. По-видимому, неравномерное деление клеток на несколько частей на одной из стадий развития довольно широко распространено среди кокков.
Таким образом, изучение тонкого строения клеток с помощью электронной микроскопии значительно расширило возможности использования морфологических показателей. Строение клеточной стенки кокков и способ их деления, по-видимому, будут широко использовать в будущем в качестве таксономических критериев.
Экология кокков и их роль в природе и жизнедеятельности человека
Как уже указывалось ранее, кокки представляют собой весьма гетерогенную группу микроорганизмов, имеющих полифилетическое происхождение. Некоторые грамотрицательные виды кокков близки по строению к сине-зеленым водорослям, часть грамположительных микрококков генетически связана, по мнению Н. А. Красильникова, с микококками и должна быть включена в класс Actinomycetes. Среди кокков есть паразиты, обитающие только в организме человека (менингококки и гонококки), приспособленные к паразитическому образу жизни и поэтому весьма трудно поддающиеся культивированию; есть сапрофитные кокки, обнаруживаемые в различных бродящих растительных субстратах (Leuconostoc pediococcus); есть строго анаэробные виды, обитающие лишь в болотах и стоячих водах (Methanosarcina); есть повсеместно распространенные в природе представители родов Micrococcus, Staphylococ-cus, Sarcina. В промышленности используется очень небольшое число видов кокков. К ним относятся Streptococcus lactis, используемый при приготовлении простокваши и кефира, Micrococcus casei и Micr. liquefaciens, применяемые в симбиозе с другими бактериями в созревании сыров.
Представители таких родов, как Pediococcus и Leuconostoc, наоборот, наносят вред при производстве пива и сахара, и с ними приходится вести борьбу. В качестве санитарно-показательных микроорганизмов, присутствующих в воздухе, считают наиболее подходящими стрептококки, постоянно обитающие в полости рта и носа людей. По концентрации этих бактерий судят о степени загрязненности воздушной среды. В воздухе необитаемых помещений стрептококки отсутствуют. При водоснабжении о степени загрязненности воды судят по количеству фекальных стрептококков, выделенных с испражнениями человека и животных.
Некоторые виды стафилококков являются источниками широко распространенных пищевых интоксикаций. Стафилококки часто обнаруживаются в изделиях из крема, в молочных, мясных и рыбных продуктах. Попадая в эти продукты из оболочки зева и носа людей, из воздуха, стафилококки, развиваясь там, выделяют энтеротоксины, не разрушающиеся при нагревании до 100 °С в течение 30 мин. Энтеротоксины стафилококков являются ядами и вызывают пищевые отравления.
Среди кокков существует много патогенных видов, вызывающих такие болезни, как менингит, крупозную пневмонию, гоноррею и пр. Некоторые виды стафилококков и стрептококков вызывают нагноение ран, септицемию, перитонит.
Таким образом, многие кокки наносят вред человеку, и с ними постоянно ведется борьба.
С другой стороны, широко распространенные в почве, воде, грязях, на поверхности живых растений и мертвых растительных остатках кокки принимают активное участие в круговороте веществ в природе. Недаром считается, что представители семейства Micrococcaceae играют роль «мусорщиков», разлагая органические остатки, осуществляя аммонификацию белковых веществ. При прямом микроскопировании почвы микробиологом С. Н. Виноградским было обнаружено большое количество кокков. Встречались как мелкие кокки (до 1 мкм в диаметре), образующие плотные скопления, заключенные в общую капсулу, так и более крупные кокки (до 2 мкм в диаметре) в менее плотных скоплениях. Эти кокковидные микроорганизмы располагались исключительно на гумусовых веществах (специфические органические вещества почвы). При использовании специальных, гуматных сред вырастали многочисленные колонии кокков. Эти кокковидные микроорганизмы, по мнению С. Н. Виноград-ского, и составляют автохтонную микрофлору почвы, т. е. микрофлору, разлагающую гумусовые вещества. Если к почве добавить легко усваиваемые органические питательные вещества, к колониям автохтонных микроорганизмов прибавятся другие формы (в основном бациллы), развивающиеся свободно в почвенном растворе и не связанные с частицами почвы и гумусовыми веществами.
Преобладание кокковых форм в почве, не получавшей в течение длительного промежутка времени легко поддающихся разложению свежих органических веществ, подтвердилось многими авторами.
При изучении вопросов адсорбции почвенных микроорганизмов оказалось, что многие представители родов Micrococcus и Sarcina обладают сильными адсорбционными свойствами. Электронно-микроскопическое изучение адсорбции микроорганизмов показало, что высокие адгезивные свойства этих организмов обусловлены наличием на их поверхности различных типов выростов. У сарцин были обнаружены перетрихиально расположенные выросты микрокапсулы, а у стафилококка — лофотрихиально расположенные шиповидные выросты. Таким образом, способность кокков адсорбироваться на поверхности почвенных частиц, отмеченная еще Виноградским, подтвердилась и получила объяснение в специальных опытах по адсорбции микроорганизмов. Следует сказать, однако, что при исследовании микрофлоры различных типов почв путем посева почвенных суспензий на различные питательные среды не обращалось внимания на количество кокков в почве, они учитывались в сумме с другими бактериальными колониями. Отсутствуют сведения о распространении различных родов и видов кокков в почвах, об их роли в почвообразовательном процессе. Тем не менее косвенные данные свидетельствуют о том, что кокки играют, по-видимому, немаловажную роль в почвообразовании. Кокковые формы бактерий, довольно редко обнаруживаемые в богатых почвах, встречаются, по данным некоторых авторов, в большом количестве на поверхности скал и в примитивных почвах. Было показано, что такой устойчивый минерал, как кварц, может разрушаться в результате подщелачивания среды в культуре Sarcina urea. Возможно, кокки наряду с микобактериями и другими неспороносными бактериями принимают участие в разрушении пород и участвуют таким образом в первичном почвообразовательном процессе. Большое количество кокковых форм микроорганизмов было обнаружено и в лишайниках, покрывающих горы Памира и,. Тянь-Шаня. В отдельных образцах лишайников кокки составили до 60 — 90% от общего числа выросших бактериальных колоний. Причем преобладали окрашенные формы кокков, что связано, по-видимому, с наличием в них пигментов, защищающих от действия повышенной ультрафиолетовой радиации.
Многие виды кокков были обнаружены и на поверхности высших растений среди прочей эпифитной микрофлоры. Причем оказалось, что кокки способны синтезировать гете-роауксин и витамины, стимулирующие рост растений. Подробное выяснение роли кокковых форм микроорганизмов в жизни почвы и растений — дело будущего.
Порядок миксобактерии (MYXOBACTER1ALES)
К этому порядку относят грамотрицательных бактерий, вегетативные клетки которых обладают большой гибкостью и способны к скользящему движению в слизи, продуцируемой ими в большом количестве. Клетки имеют палочковидную или веретенообразную форму с острыми концами. Большинство миксобактерий — аэробы, гетеротрофы.
Существенным отличием миксобактерий от истинных бактерий является их способность передвигаться за счет активного сгибания тела (жгутики отсутствуют). Такая особенность строения (эластичная клеточная стенка) свойственна простейшим животным организмам. Другой особенностью миксобактерий является образование плоских стелющихся по поверхности слизистых колоний, образующих выросты — псевдоплазмодий. Многие из них способны к образованию плодовых тел, напоминающих плодовые тела простейших. Эти тела, имеющие причудливую форму, но небольшие размеры (около 7 мм), являются разновидностью колониальной формы (рис. 113) и представляют собой стадию образования цист.
Систематическое положение миксобактерий до сих пор вызывает споры. Одни специалисты их считают родственными сине-зеленым водорослям, другие — простейшим.
Как бы ни обстояло дело с таксономией, но та группа микроорганизмов со скользящим движением, которая образует плодовые тела, в цикле своего развития претерпевает смену форм, сходную со сменой форм у простейших: стадии роения и образования цист. На стадии псевдоплазмодия миксобактерий размножаются путем поперечного деления, выделяя обильную слизь, в которой живут и перемещаются. Эта стадия продолжается 1—7 дней, после чего палочки начинают образовывать скопления, растущие над поверхностью субстрата. У некоторых видов палочки передвигаются в верхней части этих сложных структур. Там палочки укорачиваются, переходя в состояние покоящихся клеток. У миксококков они, например, становятся овальными, окрашиваются в темный цвет, приобретают толстые оболочки и становятся похожими на хламидоспоры (микроцисты) (рис. 114). При увлажнении покоящиеся вегетативные клетки прорастают и снова переходят к стадии псевдоплазмодия.
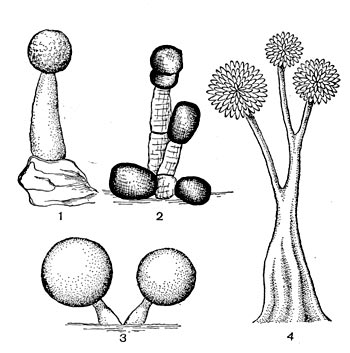
Рис. 113. Плодовые тела некоторых миксобактерий: I — Myxococcus stipitatus (высота колонии 0,1 мм); 2 — Podangium erectum (высота 50 мкм); з — Myxococcus fulvus (высота 150 мкм); 4 — Chondromyces sp. (высота 0,5 мм).
Истинные миксобактерий, образующие плодовые тела, представлены в природе следующими родами: миксококкус (Myxococcus), сорангиум (Sorangium), хондромицес (Chondromyces), хондрококкус (Chondrococcus), архангиум (Archangium), полиангиум (Polyangium), мелитангиум (Melittangium), подангиум (Podangium), стелангиум (Stelangium), синангиум (Synangium), ангиококкус (Angiococcus) (рис. 113).
По способности к скользящему движению, форме клеток с миксобактериями сходны два рода целлюлозоразлагающих бактерий — цитофага (Cytophaga) и спороцитофага (Sporocylophaga). Эти бактерии не образуют плодовых тел. Веретенообразные вегетативные клетки Sporocytophaga могут переходить в кокковидные микроцисты.
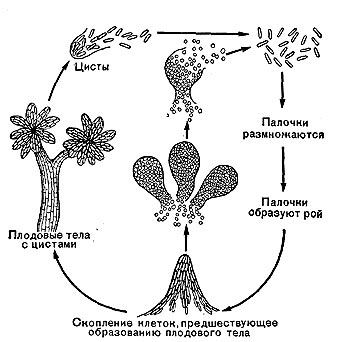
Рис. 114. Цикл развития миксобактерий из рода Chondromyces (по Шлегелю, 1972).
По ряду признаков подобны миксобактериям флексибактерии — обитатели пресной и морской воды. Клетки представителей рода Flexibacter имеют вид длинных гибких нитей толщиной менее 1 мкм, способных к скользящему движению.
Миксобактерии в природе играют очень важную роль. Многие представители этой группы активно разрушают мертвые растительные остатки (целлюлозу) и соединения, содержащиеся в наружных покровах насекомых и ракообразных (хитин), превращая их в вещества, пригодные для питания растений. Многие плодоносящие бактерии способны к внеклеточному паразитизму. Не проникая внутрь клеток жертв других бактерий и некоторых высших грибов, они вызывают их разрушение (лизис), используя освобождающиеся при этом вещества как пищу. Известны также случаи паразитизма флексибактерии на водорослях.
Порядок спирохеты (SPIROCHAETALES)
Спирохеты представляют группу бактерий, обладающих уникальной морфологией и способом движения. Клетки спирохет очень тонки (0,1—0,6 мкм), но их длина достигает 500 мкм. У клеток спирохет имеются три основные структуры: протоплазматичный цилиндр (собственно тело клетки), аксиальная (опорная) нить и трехслойная наружная оболочка. Клетки извиты, как у спирали, но обладают необычной гибкостью (рис. 115). Они способны изгибаться и сокращаться, перемещаясь винтообразно через полужидкие среды (рис. 116).
Спирохеты отличаются от других прокариотов по ряду признаков: ни один из представителей этой группы не ветвится, не образует слизистых масс, не имеет спор, включений, пигментов; размножаются клетки спирохет поперечным делением.
Рис. 115. Схема возникновения извитости клетки спирохеты за счет аксиальной нити (2). Аксиальная нить сокращена (1).
Порядок спирохет делится на два семейства: спирохеты (Spirochaetaceae), объединяющее гигантские организмы (длина клеток до 30— 500 мкм), и трепонемы (Treponemataceae), включающие более мелкие формы (4—16 мкм). Среди последних есть аэробные — лептоспира (Leptospira) — и анаэробные — трепонема (Тrеponema) и боррелия (Borrelia).
Рис. 116. Схема механизма движения спирохет
Многие представители спирохет живут как сапрофиты в пресных и соленых озерах, особенно в донных отложениях и гниющем иле. Среди этой группы бактерий многие виды являются возбудителями опасных заболеваний человека — сифилиса, инфекционной желтухи, возвратного тифа (боррелиозы). Они могут попадать в организм с водой или пищей.
Порядок микоплазмы (MYCOPLASMATALES)
Бактериальным клеткам свойственна определенная форма, придаваемая им жесткими (ригидными) клеточными стенками. Тем не менее широко распространена группа микроорганизмов, не имеющая клеточных стенок, вследствие чего они отличаются сильно выраженным плеоморфизмом (непостоянством морфологии клеток). Каждая колония состоит из клеток и частиц разной величины — кокков, нитей, розеток (рис. 117). Первоначально эта группа микроорганизмов была описана как «микроорганизмы группы PPLO» (от англ, pleuropneumonia-like-organisms) — возбудителей плевропневмонии крупного рогатого скота. Сходны с микоплазмами и L-формы бактерий, возникающие независимо от среды (спонтанно) либо под влиянием антибиотиков, аминокислот. Данные L-формы лабильные, т. е. на средах без этих веществ (пенициллина) вновь появляются нормальные клетки бактерий. Иногда L-формы становятся стабильными. В этом случае они неотличимы от микоплазм по морфологии, но обладают иным соотношением пар азотистых оснований по сравнению с истинными бактериями (% ГЦ - 23-39).
Порядок Mycoplasmatales имеет два семейства: микоплазмовые (Mycoplasmataceae) и ахо-леплазмовые (Acholeplasmataceae). Представители этих семейств различаются по потребности в стерине. Стеринзависимые организмы относят к семейству Mycoplasmataceae, не нуждающиеся в стерине — к семейству Acholeplasmataceae.
Недавно описан новый род термофильных кислотоустойчивых микоплазм — Thermomycoplasma acidofila. Этот организм выделен из каменного угля, подвергающегося саморазогреванию. Оптимальная температура для его развития равна 59 °С. Он растет в пределах 45—62°, но при 37° и 65° не растет. Оптимум рН — 1—2, культура развивается в интервале рН — 0,96—3,5, не растет при рН — 0,5 и очень слабо при рН — 4,0. Отсутствие клеточной стенки, плеоморфизм клеток, способность к почкованию, низкое содержание гуанина и цитозина (ГЦ) в ДНК, ингибирование роста антибиотиком новобиоцином, подавляющим микоплазмы, свидетельствует в пользу принадлежности этого организма к микоплазмам.
Размножение типичных представителей микоплазм (например, М. mycoides) происходит делением надвое путем распада нитей и колец на кокковидные клетки и процесса, сходного с почкованием (рис. 118). Образующиеся при этом мельчайшие клетки являются вообще мельчайшими живыми клетками, известными современной биологии, размером 0,125—0,150 мкм. Это значит, что микоплазменные минимальные клетки не только наименьшие среди организмов, имеющих клеточную структуру, но они меньше некоторых крупных вирусов. Эти клетки в 10 раз мельче средней бактерии, в 1000 раз мельче такого простейшего, как амеба. Микоплазменная клетка в 1 млрд. раз легче, чем простейшее (5-10 ~18 г). Если придерживаться линейных измерений, то следует отметить, что мельчайшая микоплазма по диаметру лишь в 1000 раз больше диаметра атома водорода (0,1 мкм больше в 1000 раз 1 ангстрема). Эти клетки соответствуют по размерам теоретически возможным наименьшим живым клеткам, учитывая толщину биологических мембран, комплекса ферментов, которые поддерживали бы 100 крайне необходимых энзи-матических реакций. В такой клетке содержится несколько больше 1200 макромолекул белка и около 12 000 000 атомов в сухом веществе.
Микоплазмы встречаются в разных источниках: в почве, сточных водах, загрязненных культурах тканей животных. Микоплазмы являются возбудителями заболеваний растений, домашней птицы, животных и человека (уретрит, плевропневмония и др.). Доказано, что непатогенные виды микоплазм способны существовать в почвах, паразитируя на других микроорганизмах (бактериях, низших грибах), способствуя существованию в природе сложных ассоциаций, описываемых в качестве самостоятельных организмов (Metallogenium, Gallionella и др., аккумулирующие железо и марганец бактерий). Есть сведения в пользу существования сапрофитных форм микоплазм.
Порядок риккетсии (RICKETTSIALES)
В порядке Rickettsiales, имеющем одно семейство риккетсовые (Rickettsiaceae), объединены типичные представители класса молликуты (Mollicutes), получившие название в честь американского ученого Риккетса, впервые описавшего возбудителей пятнистой лихорадки и сыпного тифа. Риккетсии (род Rickettsia) представляют собой мелкие грамотрицательные кокковидные или палочковидные клетки, имеющие 1—2 мкм в длину и 0,3—0,7 мкм в поперечнике. По тонкому строению они неотличимы от типичных грамотрицательных бактерий. Риккетсии способны запасать энергию в АТФ и обладают цитохромной системой. Один вид культивируется вне клетки на искусственной среде.
Представители рода Rickettsia являются возбудителями многих опасных болезней животных и человека (разные типы лихорадок, сыпной тиф, риккетсиозная оспа). Естественными очагами резервации и переносчиками риккет-сий являются членистоногие (клещи, пухоеды, блохи, вши). Представителями другого родственного рода коксиэлла (Goxiella) переносятся с пылью, молоком, сохраняя при этом жизнеспособность.
Порядок хламидии (CHLAMYDIALES)
Порядок Chlamydiales объединяет одно семейство хламидиевые (Chlamydiaceae) и один род хламидии (Ghlamydia). Хламидии являются типичными облигатными внутриклеточными энергетическими паразитами. В отличие от риккетсий они, будучи анаэробами, не обладают цитохромами, не способны генерировать АТФ (используют энергодающие соединения АТФ, НАД в клетках хозяина). Экстрацеллюлярное культивирование хламидии в отличие от риккетсий невозможно. Они отличаются также способом размножения и сложным циклом развития. Внутри цитоплазматической вакуоли клетки хозяина вначале развиваются крупные вегетативные клетки со слабыми, неригидными клеточными стенками. Эти клетки размножаются делением, но не являются инфекционными. Дочерние организмы формируются путем постепенной конденсации с образованием мелких инфекционных форм с ригидной клеточной стенкой. Они освобождаются после разрыва мембраны клетки хозяина. Обе указанные формы сильно различаются между собой по ряду признаков (в частности, по соотношению ДНК и РНК).
|
ПОИСК:
|
© GEOMAN.RU, 2001-2020
При использовании материалов сайта активная ссылка обязательна:
http://plant.geoman.ru/ 'Растения: виды, места произрастания, полезные свойства'
При использовании материалов сайта активная ссылка обязательна:
http://plant.geoman.ru/ 'Растения: виды, места произрастания, полезные свойства'